Chọn B.
Dung dịch Y có n A l 2 ( S O 4 ) 3 = V/3 = x m o l và n A l C l 3 = V 3 = x m o l .
⇒ n A l 3 + = 3 x m o l = n S O 4 2 -
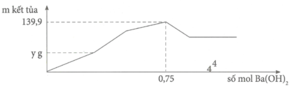
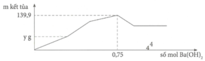
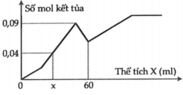
Tại n B a ( O H ) 2 = 0,75 mol => n O H - = 1,5 mol: lúc này cả 2 kết tủa tối đa với
n A l ( O H ) 3 = 1 / 3 n O H - = 0 , 5 m o l ⇒ n B a S O 4 m a x . 233 + 0 , 5 . 78 = 139 , 9 ⇒ n B a S O 4 m a x = 0 , 433 < 0 , 5 ⇒ v ô l ý
Chứng tỏ trong dung dịch Y còn H+ dư đoạn đồ thị đi lên đầu tiên đến y chỉ có 2 phản ứng là: H + + O H - → H 2 O ⇒ n O H - kết tủa hết Al3+ = 1,5 - a
⇒ n A l ( O H ) 3 m a x = 1 , 5 - a 3 ( 1 ) S O 4 2 - + B a 2 + → B a S O 4 (1)
Dung dịch Y ( : x mol, Cl-: x mol, H+: a mol)
Bảo toàn điện tích: n A l 3 + = 3 x - a 3 ⇒ n A l ( O H ) 3 m a x = 3 x - a 3 (2)
Từ (1) và (2), ta được: x = 0,5 mol
Tại kết tủa tối đa: 139 , 9 = n B a S O 4 m a x + n A l ( O H ) 3 m a x = 233 x + 78 ( 3 x - a ) 3
Thay x = 0,5 vào a = 0,6 mol = n(H+) dư n(Ba(OH)2) dùng cho đoạn y (trung hòa hết H+ dư = 0,3 mol tại y chính là kết tủa
BaSO4: n(BaSO4) = n(Ba(OH)2) = 0,3 mol
=>y = 0,3.233= 69,9 gam ≈ 70 gam.