Hòa tan hoàn toàn hỗn hợp X gồm BaO, N H 4 H C O 3 , N a H C O 3 (có tỷ lệ mol lần lượt là 5 : 4 : 2) vào nước dư, đun nóng. Đến khi các phản ứng xảy ra hoàn toàn thu được dung dịch Y chứa
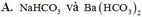
![]()
![]()
![]()
Nung nóng 5,6g bột săt trong bình đựng õi thu đc 7,36g hỗn hợp X gồm Fe,Fe2O3,Fe3O4.Cho X hòa tan hoàn toàn trong dung dịch HNO3 thu đc V litd đktc hỗn hợp khí Y gồm NO và N2O4 tỉ khối hơi Y so với H2 là 25,33g.Tính giá trị của V
PHƯƠNG PHÁP BẢO TOÀN ELECTRON
Để khử hoàn toàn 3,04g hỗn hợp X gồm FeO, Fe2O3, Fe3O4, cần 0,55 mol H2.Mặt khác hòa tan hoàn toàn 3,04g hỗn hợp X trong dung dịch H2SO4 đặc nóng thì thu được V(l) SO2 ở đktc (sản phẩm khử duy nhất).
đề là 0,05 h2..mới đúng ..có h2..thì tìm đk o-..rồi bảo toàn e là ra
chia m g hỗn hợp X gồm 2 kim loại A,B có hóa trị không đổi thành hai phần bằng nhau:
- phần 1: hòa tan hoàn toàn trong hỗn hợp hai axit HCl loãng và H2SO4 giải phóng được 33,6 lít H2 đkc
-phần 2: hòa tan hoàn toàn trong H2SO4 đặc và chỉ tạo ra V lít SO2 đkc
Giá trị của V là:
A. 1,68 lít B. 1,746 lít C. 0,323 lít D.tất cả sai
PTHH
2A + nH2SO4 --> A2(SO4)n +nH2
2B + mH2SO4 --> B2(SO4)m +mH2
2A +2nH2SO4đ -->A2(SO4)n+nSO2+2nH2O
2B+2mH2SO4đ---->B2(SO4)m+mSO2+2mH2O
Ta thấy nH2 = nSO2
=> VSO2 = VH2 = 33.6 l
hòa tan hoàn toàn 2,81g hỗn hợp gồm Fe2O3 , MgO, ZnO trong 500 ml H2SO4 0,1M vừa đủ. Sau phản ứng hỗn hợp muối sunphat khan khi cô cạn thu được là bao nhiêu?
GIÚP MÌNH TÌM CÁCH GIẢI VỚI
Dung` DL BTKL: moxit + mH2SO4 = mmuoi' + mH2O
voi' nH2O = nH2SO4 = 0.5*0.1 = 0.05
--> mmuoi' = 2.81 + 0.05*98 - 0.05*18 = 6.81g
Cach' #: (Fe2O3, MgO, ZnO) ----> (Fe2(SO4)3; MgSO4, ZnSO4)
--> nO = nSO4(2-) = nH2SO4 = 0.05
--> m(Fe, Mg, Zn) = 2.81 - mO = 2.81 - 0.05*16 = 2.01g
mmuoi' = mKL + mSO4(2-) = 2.01 + 0.05*96 = 6.81g
Hòa tan hỗn hợp gồm 27,2 gam Zn và Fe trong 1 mol dung dịch H2SO4.
a, Chứng minh rằng hỗn hợp tan hết.
b, Nếu hòa tan hỗn hợp trên với lượng gấp đôi vào cùng lượng axit trên thì hỗn hợp có tan hết không?
m hỗn hợp = 27,2 gam
=> \(\frac{27,2}{65}< n_{KL}< \frac{27,2}{56}\)
<=> 0,418 < nKL < 0,485 mol
Gọi CT chung 2 kim loại là R
R + H2SO4 -> RSO4 + H2
Dễ thây nR = nH2SO4
=> Số mol axit cần để hòa tan: 0,418 < nH2SO4 < 0,485 mol <1 mol H2SO4.
=> Axit dư, KL tan hết.
b. Khi tăng lượng KL gấp đôi ta có
0,418x2 < nhh < 0,485x2 (mol)
nKL < 1 mol => KL vẫn tan hết.
Cho 19,1g hỗn hợp gồm Ba và Al phản ứng hoàn toàn với 6,72l hỗn hợp khí gồm Cl2 và O2 (đktc), thu được 36,5g hỗn hợp X gồm các muối và oxit. Hòa tan hoàn toàn hỗn hợp X vào dung dịch H2SO4 dư, thu được m(g) kết tủa. Tính giá trị của m.
Gọi số mol O2 là a Cl2 là b
Ta có\(\left\{{}\begin{matrix}\text{32a+71b=36,5-19,1=17,4}\\\text{a+b=0,3}\end{matrix}\right.\rightarrow\left\{{}\begin{matrix}x=0,1\\y=0,2\end{matrix}\right.\)
Gọi số mol Ba là x số mol Al là y
Bảo toàn e ta có\(\left\{{}\begin{matrix}\text{2x+3y=4a+2b=0,8}\\\text{137x+27y=19,1}\end{matrix}\right.\rightarrow\left\{{}\begin{matrix}x=0,1\\y=0,2\end{matrix}\right.\)
\(\rightarrow\)m=mBaSO4=0,1.233=23,3(g)
Cho hỗn hợp A gồm 16g Fe2O3 ; 6,4g CuO vào 160ml dung dịch H2SO4 vừa đủ
a) Tính khối lượng muối thu được
b) Tính CM H2SO4
c) Nếu thay H2SO4 ở trên bằng dung dịch X gồm HCl 1M ; H2SO4 0,5M thì Vdd X là bao nhiêu để hòa tan hỗn hợp A ?
a,
Ta có :
\(\text{nFe2O3=16/16=0,1(mol)}\)
\(\text{nCuO=6,4/80=0,08(mol)}\)
\(\Rightarrow\)m muối=mFe2(SO4)3+mCuSO4=0,1x400+0,08x160=52,8(g)
b)
nH2SO4=0,1x3+0,08=0,38(mol)
\(\Rightarrow\text{CM=0,38/0,16=2,375(M)}\)
c)
Gọi a là V dd X
\(\Rightarrow\text{V+V=0,38=>V=0,19(l)}\)
Chia 17 gam hỗn hợp X gồm: MxOy; CuO và Al2O3 thành 2 phần bằng nhau.
- Hòa tan phần 1 vào dung dịch NaOH dư, còn lại 7,48 gam hỗn hợp rắn A.
- Dẫn 4,928 lít khí CO (đktc) vào phần 2 nung nóng được hỗn hợp rắn B và hỗn hợp khí C, có tỉ khối đối với hidro là 18. Hòa tan B vào dd HCl dư còn lại 3,2 gam Cu.
a) Tính % về khối lượng của mỗi nguyên tố có trong hỗn hợp X. Các pứ xảy ra hoàn toàn.
b) Để hòa tan hoàn toàn A phải dùng hết 12,5 gam dd H2SO4 98% nóng. Xác định kim loại M và công thức của MxOy.
Biết: MxOy + H2SO4 đặc, nóng -> M2(SO4)3 + SO2 + H2OxOy
MxOy bị CO khử và không tan trong dd NaOH.
hòa tan 15g hỗn hợp X gồm Mg và Al vào dung dịch Y gồm HNO3 và H2SO4 thiu được 0,1 mol mỗi khí SO2,NO,NO2,N2O. thành phần phần trăm theo khối lượng cư Mg và Al là bao nhiêu ở trong hỗn hợp X.
các bạn giải giúp mình bằng cách bảo toàn electron nha
Các quá trình khử :
N{+5} + 3e = N{+2} ; N{+5} + e = N{+4} ; 2N{+5} + 8e = 2N{+1} ; S{+6} + 2e = S{+4}
Ʃne (HNO3 nhận) = 3.nNO + nNO2 + 8.nN2O + 2.nSO2 = 1,4 mol
Các quá trình oxy hóa :
Mg - 2e = Mg{+2} ; Al - 3e = Al{+3}
Áp dụng định luật bảo toàn electron, ta có :
2.nMg + 3.nAl = 1,4
Mặt khác, 24.nMg + 27.nAl = 15
=> nMg = 0,4 mol và nAl = 0,2 mol
=> %mMg = 64% và %mAl = 36%
Áp dụng định luật bảo toàn electron, ta có :
2.nMg + 3.nAl = 1,4
Mặt khác, 24.nMg + 27.nAl = 15
mình chưa hiểu
n là như thế nào vậy bạn
Hòa tan 57,6 gam hỗn hợp gồm Al2O3và CaO vào 640ml dd H2SO4 2,5 M có dư. Sau phản ứng có 177,6 gam muối sunfat được tạo thành.
a) Tính thành phần trăm về khối lượng mỗi oxit trong hỗn hợp.
b) Tính thể tích dd H2SO4 dư.
c) Cần dùng bao nhiêu gam dd HCl 15% đề hòa tan hoàn toàn hỗn hợp các axit nói trên.