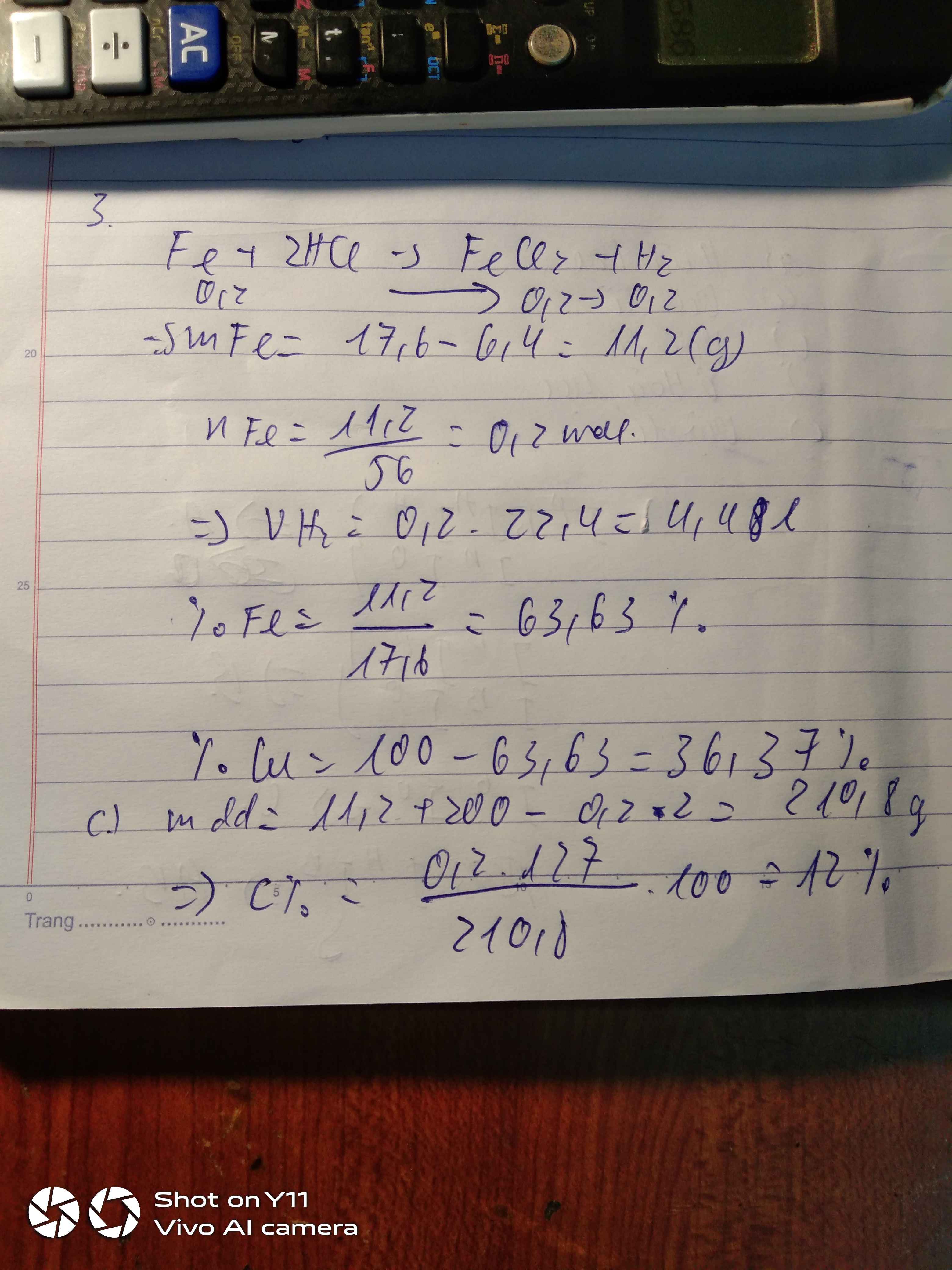Cho 12,8g feo và fe vào dung dịch hcl thấy có khí h2 bay lên. Tính % kl của mỗi chất trong hỗn hợp ban đầu

Những câu hỏi liên quan
Hoà tan hết 12 gam hỗn hợp gồm Fe và FeO vào dung dịch HCl vừa đủ, phản ứng xong thu được 211,7 gam dung dịch A và 3,36 lít khí H2 ở ĐKTC.
a) Tính khối lượng mỗi chất trong hỗn hợp ban đầu
b) Tính nồng độ phần trăm của dung dịch HCl đã dùng.
c) Tính nồng độ phần trăm của chất có trong dung dịch A
a,Fe + 2HCl → FeCl + H2 (1)
FeO + 2HCl → FeCl + H2O (2)
nH2 = 3,36/ 22,4 = 0,15 ( mol)
Theo (1) nH2 = nFe = 0,15 ( mol)
mFe = 0,15 x 56 = 8.4 (g)
m FeO = 12 - 8,4 = 3,6 (g)
Đúng 0
Bình luận (0)
a, \(n_{H_2}=\frac{3,36}{22,4}=0,15\left(mol\right)\)
\(Fe+2HCl->FeCl_2+H_2\left(1\right)\)
\(FeO+2HCl->FeCl_2+H_2O\left(2\right)\)
theo (1) \(n_{Fe}=n_{H_2}=0,15\left(mol\right)\)
=> \(m_{Fe}=0,15.56=8,4\left(g\right)\)
=> \(m_{FeO}=12-8,4=3,6\left(g\right)\)
Đúng 0
Bình luận (0)
Hoà tan hết 12 gam hỗn hợp gồm Fe và FeO vào dung dịch HCl vừa đủ, phản ứng xong thu được 211,7 gam dung dịch A và 3,36 lít khí H2 ở ĐKTC.
a) Tính khối lượng mỗi chất trong hỗn hợp ban đầu
b) Tính nồng độ phần trăm của dung dịch HCl đã dùng.
c) Tính nồng độ phần trăm của chất có trong dung dịch A
ta thấy : nFe =nH2 = 0,15
=> mFe =0,15 x 56 = 8,4g
%Fe=8,4/12 x 100 = 70%
=>%FeO = 100 - 70 = 30%
b) BTKLra mdd tìm mct of HCl
c) tìm mdd sau pứ -mH2 nha bạn
Đúng 0
Bình luận (0)
Hòa tan hết 12,8g hỗn hợp gồm Fe và FeO bằng dd HCl 2M. Sau phản ứng thu được 2,24 lít khí (đktc). Tính a. Thành phần% về khối lượng của mỗi chất có trong hỗn hợp. b. Thể tích dung dịch HCl cần dùng
Fe + 2HCl -> FeCl2 + H2
0.2 0.1
FeO + 2HCl -> FeCl2 + H2O
0.1 0.2
a.\(nH2=\dfrac{2.24}{22.4}=0.1mol\)
\(\%mFe=\dfrac{0.1\times56\times100}{12.8}=43.8\%\)
\(\%mFeO=100-43.8=56.2\%\)
b.\(nFeO=\dfrac{12.8-\left(0.1\times56\right)}{56+16}=0.1mol\)
\(V_{HCl}=\dfrac{0.2+0.2}{2}=0.2l\)
Đúng 1
Bình luận (0)
Cho dung dịch HCl 0,5M tác dụng vừa đủ với 21,6 gam hỗn hợp A gồm Fe, FeO,
FeCO
3
. Thấy thoát ra một hỗn hợp khí có tỉ khối đối với
H
2
là 15 và tạo ra 31,75 gam muối clorua. Tính % khối lượng của mỗi chất trong hỗn hợp A.
Đọc tiếp
Cho dung dịch HCl 0,5M tác dụng vừa đủ với 21,6 gam hỗn hợp A gồm Fe, FeO, FeCO 3 . Thấy thoát ra một hỗn hợp khí có tỉ khối đối với H 2 là 15 và tạo ra 31,75 gam muối clorua. Tính % khối lượng của mỗi chất trong hỗn hợp A.
Phương trình hóa học :
Fe + 2HCl → FeCl 2 + H 2
FeO + 2HCl → FeCl 2 + H 2 O
FeCO 3 + 2HCl → FeCl 2 + H 2 O + CO 2
Tính % khối lượng: Gọi số mol Fe, FeO, FeCO 3 trong hỗn hợp là x, y, z => x + y + z = 0,25
Theo phương trình hóa học : Số mol H 2 , CO 2 là x, z
![]()
Mặt khác : 56x + 72y + 116z = 21,6
Giải ra ta có:
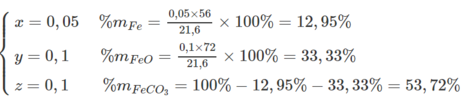
Đúng 0
Bình luận (1)
Cho 3,78g hỗn hợp gồm Al và Mg vào dung dịch HCl 0,5M thu được 9,916 lít khí H2
a) tính thể tích dung dịch HCl đã phản ứng
b) tính thành phần % theo khối lượng mỗi chất có trong hợp chất ban đầu
a, \(n_{H_2}=\dfrac{9,916}{24,79}=0,4\left(mol\right)\)
PT: \(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(Mg+2HCl\rightarrow MgCl_2+H_2\)
Theo PT: \(n_{HCl}=2n_{H_2}=0,8\left(mol\right)\Rightarrow V_{HCl}=\dfrac{0,8}{0,5}=1,6\left(l\right)\)
b, Gọi: \(\left\{{}\begin{matrix}n_{Al}=x\left(mol\right)\\n_{Mg}=y\left(mol\right)\end{matrix}\right.\) ⇒ 27x + 24y = 3,78 (1)
Theo PT: \(n_{H_2}=\dfrac{3}{2}n_{Al}+n_{Mg}=\dfrac{3}{2}x+y=0,4\left(mol\right)\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=\\y=\end{matrix}\right.\)
Đến đây thì ra số mol âm, bạn xem lại đề nhé.
Đúng 1
Bình luận (0)
Hòa tan hoàn toàn 17,6g hỗn hợp bột Cu và Fe vào 200g dung dịch HCl sau phản ứng thu được 6,4g chất rắn a) Viết PTHH b) Tính thể tích H2 (đktc) và phần trăm theo khối lượng của mỗi KL trong hỗn hợp ban đầu c) Hãy tính nồng độ % dd muối thu được sau phản ứng
Hoà tan 12,8g hỗn hợp gồm Fe,FeO bằng dung dịch HCl 0,1M vừa đủ thu được 2,24 lít khí(đktc) và dung dịch A 1.Thành phần % khối lượng của hỗn hợp 2.Tính nồng độ M của muối có trong dung dịch A
nH2 = 2.24/22.4 = 0.1 (mol)
Fe + 2HCl => FeCl2 + H2
0.1___0.2_____0.1___0.1
mFeO = 12.8 - 0.1*56 = 7.2 (g)
nFeO = 7.2/72 = 0.1 (mol)
FeO + 2HCl => FeCl2 + H2O
0.1____0.2______0.1
%Fe = 5.6/12.8 * 100% = 43.75%
%FeO = 56.25%
nHCl = 0.2 + 0.2 = 0.4 (mol)
Vdd HCl = 0.4/0.1 = 4(l)
nFeCl2 = 0.1 + 0.1 = 0.2 (mol)
CM FeCl2 = 0.2/4 = 0.05 (M)
Đúng 1
Bình luận (0)
1) cho 22g hỗn hợp gồm Al, Fe vào 200ml dung dịch HCl ư, sau phản ứng thu đc 200ml dung dịch B và 17,92l khí H2. Bt lượng HCL dùng dư 20% so với lượng phản ứng. Tính % khối lượng mỗi KL trog hỗn hợp A và CM các chất tan trog dung dịch B2) cho 100ml dung dịch gồm NaCO3 0,5M và NaHCO3 0,4M tác dụng vs 100ml dung dịch HCl 2M, sau phản ứng thu đc V lít khí CO2 và dung dịch X. tính V và CM chất tan trog dung dịch X
Đọc tiếp
1) cho 22g hỗn hợp gồm Al, Fe vào 200ml dung dịch HCl ư, sau phản ứng thu đc 200ml dung dịch B và 17,92l khí H2. Bt lượng HCL dùng dư 20% so với lượng phản ứng. Tính % khối lượng mỗi KL trog hỗn hợp A và CM các chất tan trog dung dịch B
2) cho 100ml dung dịch gồm NaCO3 0,5M và NaHCO3 0,4M tác dụng vs 100ml dung dịch HCl 2M, sau phản ứng thu đc V lít khí CO2 và dung dịch X. tính V và CM chất tan trog dung dịch X
Hoà tan 8,6g hỗn hợp Fe & FeCO3 bằng 300g dung dịch HCl 7,3% thu được dung dịch Y và 2,24 dm3 hỗn hợp X gồm 2 khí ở đktc. a,Tính số gam mỗi chất trong hỗn hợp ban đầu và C% các chấtt trong dung dịch Y b. Tính dX/H2
Đọc tiếp
Hoà tan 8,6g hỗn hợp Fe & FeCO3 bằng 300g dung dịch HCl 7,3% thu được dung dịch Y và 2,24 dm3 hỗn hợp X gồm 2 khí ở đktc.
a,Tính số gam mỗi chất trong hỗn hợp ban đầu và C% các chấtt trong dung dịch Y
b. Tính dX/H2
a)
\(n_{HCl}=\dfrac{300.7,3\%}{36,5}=0,6\left(mol\right)\)
PTHH: Fe + 2HCl --> FeCl2 + H2
FeCO3 + 2HCl --> FeCl2 + CO2 + H2O
\(n_{khí}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
Theo PTHH, nHCl(pư) = 2.nkhí = 0,2 (mol) < 0,6 (mol)
=> HCl dư
Gọi số mol Fe, FeCO3 là a, b (mol)
=> \(\left\{{}\begin{matrix}56a+116b=8,6\\a+b=0,1\end{matrix}\right.\)
=> a = 0,05 (mol); b = 0,05 (mol)
=> \(\left\{{}\begin{matrix}m_{Fe}=0,05.56=2,8\left(g\right)\\m_{FeCO_3}=0,05.116=5,8\left(g\right)\end{matrix}\right.\)
nFeCl2 = 0,1 (mol) => mFeCl2 = 0,1.127 = 12,7 (g)
nHCl(dư) = 0,6 - 0,2 = 0,4 (mol) => mHCl(dư) = 0,4.36,5 = 14,6 (g)
mdd sau pư = 8,6 + 300 - 0,05.2 - 0,05.44 = 306,3 (g)
\(\left\{{}\begin{matrix}C\%_{FeCl_2}=\dfrac{12,7}{306,3}.100\%=4,146\%\\C\%_{HCl\left(dư\right)}=\dfrac{14,6}{306,3}.100\%=4,767\%\end{matrix}\right.\)
b)
\(\overline{M}_X=\dfrac{0,05.2+0,05.44}{0,05+0,05}=23\left(g/mol\right)\)
=> \(d_{X/H_2}=\dfrac{23}{2}=11,5\)
Đúng 3
Bình luận (0)