Hòa tan hoàn toàn 15,4 gam hỗn hợp Mg và Zn trong dung dịch HCl dư thấy có 0,6 gam khí H2 bay ra. Khối lượng muối tạo ra trong dung dịch là
A. 36,7 gam
B. 35,7 gam
C. 63,7 gam
D. 53,7 gam
Giải bài tập sách giáo khoa
Hòa tan hoàn toàn 15,4 gam hỗn hợp Mg và Zn trong dung dịch HCl dư thấy có 0,6 gam khí H2 bay ra. Khối lượng muối tạo ra trong dung dịch là
A. 36,7 gam
B. 35,7 gam
C. 63,7 gam
D. 53,7 gam
Hòa tan 1,44 gam một kim loại hóa trị II trong 150 ml dung dịch H2SO4 0,5M. Để trung hòa axit dư trong dung dịch thu được thì phải dùng hết 30ml dung dịch NaOH 1M. Kim loại đó là
A. Ba
B. Ca
C. Mg
D. Be
Thảo luận (2)Hướng dẫn giảiC. Gọi kim loại cần tìm là R. Các PTHH:
R + H2SO4 → RSO4 +H2 (1)
H2SO4 + 2NaOH → Na2SO4 + H2O (2)
Số mol của H2SO4 bằng: 0,15.0,5 = 0,075 (mol);
Số mol của NaOH bằng: 0,03.1 = 0,03 (mol)
=> Số mol của H2SO4 ở (1) bằng: 0,075 -
= 0,06 (mol).
Từ (1) => nR =
= 0,06; mR =
= 24 (g/mol)
Vậy R là Mg
(Trả lời bởi Lê Thiên Anh)
Thủy ngân dễ bay hơi và rất độc. Nếu chẳng may nhiệt kế thủy ngân bị vỡ thì dùng các chất nào trong các chất sau để khử độc thủy ngân?
A. Bột sắt.
B. Bột lưu huỳnh.
C. Bột than.
D. Nước.
Thảo luận (3)Hướng dẫn giải
Cho 5,5 gam hỗn hợp bột Al và Fe ( tỉ lệ mol 2:1) vào 330 ml dung dịch AgNO31M. Khuấy kĩ cho oharn ứng xẩy ra hoàn toàn thu được m gam chất rắn. Giá trị của m là
A. 33,95 gam
B. 35,20 gam
C. 39,35 gam
D. 35,39 gam
Thảo luận (2)Hướng dẫn giảiChọn B
Gọi số mol Fe là x => số mol Al là 2x
Ta có: 56x + 27.2x = 5,5 => x = 0,05;
= 0,3.1 = 0,3 (mol)
Al + 3Ag+ → Al3+ + 3Ag
0,1 0,3 0,3 (mol)
Vậy chất rắn thu được gồm Fe và Ag; m = 0,05.56 + 108.0,3 = 35,2 (gam).
(Trả lời bởi Lê Thiên Anh)
Những tính chất vật lí chung của kim loại ( dẫn điện, dẫn nhiệt, dẻo, ánh kim) gây nên chủ yếu bởi
A. cấu tạo mạng tinh thể kim loại.
B. khối lượng riêng của kim loại.
C. tính chất của kim loại.
D. các electron tự do trong tinh thể kim loại.
Thảo luận (3)Hướng dẫn giảiD. Các kim loại electron tự do trong tinh thể kim loại
(Trả lời bởi Trần Huy Hoang)
Ngân 2,33 gam hợp kim Fe-Zn trong lượng dư dung dịch HCl đến khi phản ứng xẩy ra hoàn toàn thấy giải phóng 896 ml khí H2 (đktc). Thành phần phần trăm về khối lượng của hợp kim này là
A. 27,9% Zn và 72,1% Fe
B. 26,9% Zn và 73,1% Fe
C. 25,9% Zn và 74,1% Fe
D. 24,9% Zn và 75,1% Fe
Thảo luận (2)Hướng dẫn giảiChọn A.
Zn + 2H+ → Zn2+ + H2
Fe + 2H+ → Fe2+ + H2
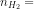
= 0,04 (mol)
Gọi x và y là số mol của Zn và Fe
Ta có hệ phương trình:
=> x = 0,01; y = 0,03
%mZn =
.100% = 27,9%; %mFe = 72,1%
(Trả lời bởi Nhật Linh)
Trong hai trường hợp sau đây, trường hợp nào vỏ tàu được bảo vệ ? Giải thích.
- Vỏ tàu bằng thép được nối với thanh kẽm.
- Vỏ tàu bằng thép được nối với thanh đồng.
Thảo luận (2)Hướng dẫn giảiTrong 2 trường hợp trên, vỏ tàu bằng thép được nối với thanh kẽm được bảo vệ vì: Kẽm là kim loại hoạt động hơn sắt nên bị ăn mòn, còn sắt thì không bị mất mát gì
=> Sau 1 thời gian, khi miếng kẽm bị ăn mòn hết thì sẽ được thay thế theo định kì nên sẽ đỡ tốn chi phí sửa chữa thân tàu.
(Trả lời bởi Hoàng Tuấn Đăng)
Cho lá sắt vào
a. dung dịch H2SO4 loãng.
b. dung dịch H2SO4 loãng có thêm vài giọt dung dịch CuSO4.
Nêu hiện tượng xẩy ra, giải thích và viết phương trình hóa học của các phản ứng trong mỗi trường hợp.
Thảo luận (1)Hướng dẫn giải1. Cho lá sắt kim loại vào:
a) Lúc đầu xuất hiện bọt khí thoát ra từ á sắt, sắt tan dần. Sau đó khí thoát ra chậm dần, do bọt khí bám trên bề mặt lá sắt ngăn sự tiếp xúc của sắt với dung dịch H2SO4.
Fe + H2SO4 = FeSO4 + H2↑
b)
– Lúc đầu bề mặt lá sắt có kim loại màu đỏ bám vào, sau đó khí thoát ra nhanh hơn, sắt bị hoà tan nhanh do có sự ăn mòn điện hoá
Fe + CuSO4 = FeSO4 + Cu↓
– Trong dung dịch H2SO4, lá sắt kim loại là cực âm, kim loại đồng là cực dương. Tại cực âm, sắt kim loại bị oxi hoá : Fe -2e -> Fe2+. Tại cực dương, ion H+ bị khử 2H+ +2e -> H2 :
(Trả lời bởi Nguyễn Đinh Huyền Mai)
Một dây phơi quần áo gồm một đoạn dây đồng nối với một đoạn dây thép. Hiện tượng nào xẩy ra ra ở chỗ nối hai đoạn dây khi để lâu ngày?
A. Sắt bị ăn mòn.
B. Đồng bị ăn mòn.
C. Sắt và đồng đều bị ăn mòn.
D. Sắt và đồng đều không bị ăn mòn.
Thảo luận (2)Hướng dẫn giảiTheo dạy hoạt động hóa học kim loại, sắt có độ hoạt động hóa học mạnh hơn đồng. Thép là hợp kim của sắt nên cũng có thể coi thép là sắt trong trường hợp này. Do đó thép bị an mòn hết .
=> Chọn đáp án A
(Trả lời bởi Hoàng Tuấn Đăng)
Để khử hoàn toàn 30 gam hỗn hợp gồm CuO, FeO, Fe3O4, Fe2O3, Fe, MgO cần dùng 5,6 lít khí CO (đktc). Khối lượng chất rắn thu được sau phản ứng là
A. 28 gam
B. 26 gam
C. 24 gam
D. 22 gam
Thảo luận (3)Hướng dẫn giải