| px | py | pz |
Giống nhau | Đều có hình dạng là số 8 nổi | ||
Khác nhau | Nằm trên trục Ox | Nằm trên trục Oy | Nằm trên trục Oz |
giống nhau: Đều có dạng số 8
Khác nhau | px: Nằm trên trục Ox | py: Nằm trên trục Oy | pz:Nằm trên trục Oz |
| px | py | pz |
Giống nhau | Đều có hình dạng là số 8 nổi | ||
Khác nhau | Nằm trên trục Ox | Nằm trên trục Oy | Nằm trên trục Oz |
giống nhau: Đều có dạng số 8
Khác nhau | px: Nằm trên trục Ox | py: Nằm trên trục Oy | pz:Nằm trên trục Oz |
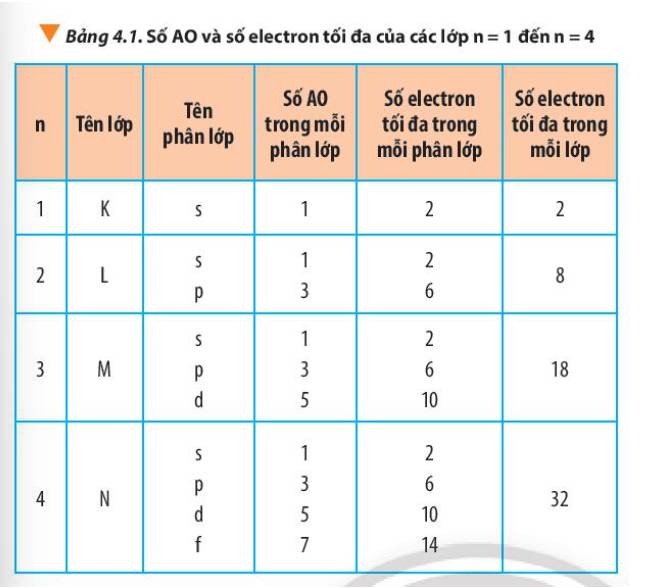
Quan sát Hình 4.8, cho biết cách biểu diễn 2 electron trong một orbital dựa trên cơ sở nào.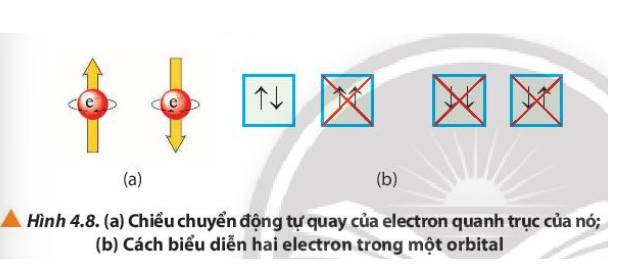
Quan sát Hình 4.1 và 4.2, so sánh điểm giống nhau và khác nhau giữa mô hình Rutherford – Bohr với mô hình hiện đại mô tả sự chuyển động của electron trong nguyên tử.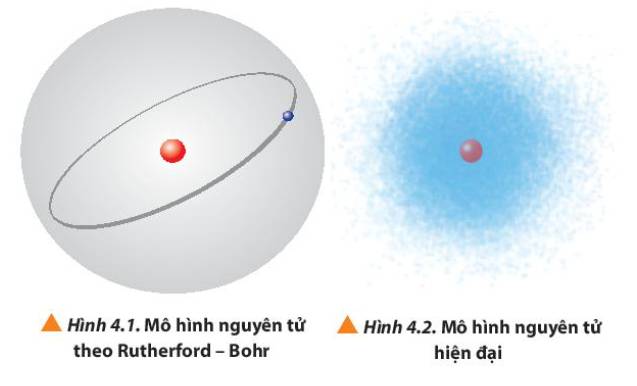
Cho biết khái niệm orbital nguyên tử xuất phát từ mô hình nguyên tử của Rutherford – Bohr hay mô hình nguyên tử hiện đại.
Quan sát Hình 4.3, phân biệt khái niệm đám mây electron và khái niệm orbital nguyên tử.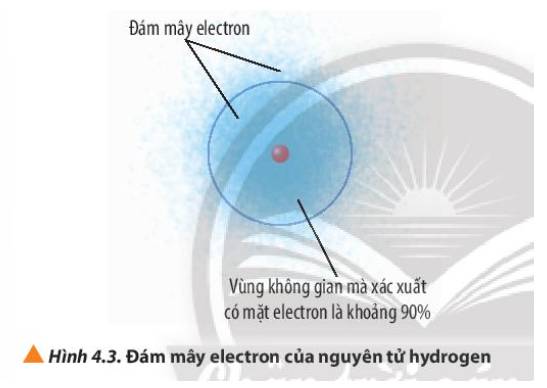
Hãy đề nghị cách phân bố electron vào các orbital để số electron độc thân là tối đa.
Viết cấu hình electron nguyên tử của nguyên tố aluminium (Z = 13) và biểu diễn cấu hình electron của aluminium theo ô orbital. Từ đó, xác định số electron độc thân của nguyên tử này.
Trong các cách biểu diễn electron và các orbital của phân lớp 2p ở trạng thái cơ bản, hãy chọn cách phân bố đúng: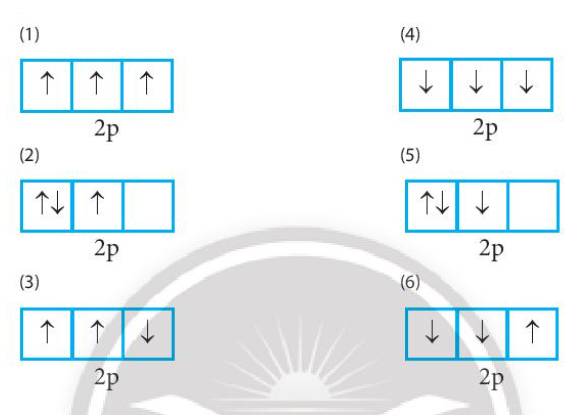
Trong các trường hợp (a) và (b) dưới đây, trường hợp nào có sự phân bố electron vào các orbital tuân theo và không tuân theo quy tắc Hund.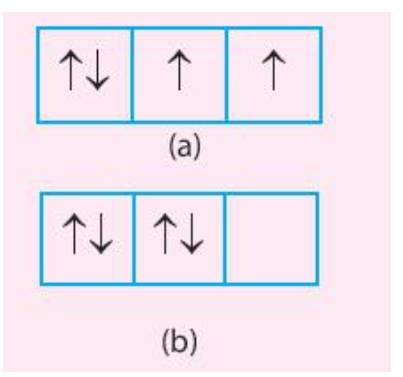
Từ Bảng 4.1, hãy chỉ ra mối quan hệ giữa số thứ tự lớp và số electron tối đa trong mỗi lớp.