Cl2+NaOH->NaCl+NaClO3+H2O
\(Cl^0\rightarrow Cl^{+5}+5e\)(x1)
\(Cl^0+1e\rightarrow Cl^{-1}\)(x5)
=>Cl vừa là chất oxi hóa, vừa là chất khử
=>PT: \(3Cl_2+6NaOH\rightarrow5NaCl+NaClO_3+3H_2O\)
Cl2+NaOH->NaCl+NaClO3+H2O
\(Cl^0\rightarrow Cl^{+5}+5e\)(x1)
\(Cl^0+1e\rightarrow Cl^{-1}\)(x5)
=>Cl vừa là chất oxi hóa, vừa là chất khử
=>PT: \(3Cl_2+6NaOH\rightarrow5NaCl+NaClO_3+3H_2O\)
Xác định chất oxi hóa, chất khử trong phản ứng sodium và iron với chlorine, dùng mũi tên chỉ rõ sự nhường electron từ chất khử sang chất oxi hóa.
Phản ứng thế của một số muối halide
Chuẩn bị: 3 ống nghiệm, dung dịch NaBr, dung dịch NaI, nước Cl2, nước Br2 loãng.
Tiến hành:
- Lấy khoảng 2 mL dung dịch NaBr vào ống nghiệm (1), 2 mL dung dịch NaI vào mỗi ống nghiệm (2) và (3)
- Thêm vào ống nghiệm (1) và (2) vài giọt nước Cl2, thêm vào ống (3) vài giọt nước Br2, lắc đều các ống nghiệm
Lưu ý: Cẩn thận không để nước Cl2, nước Br2 giây ra tay, quần áo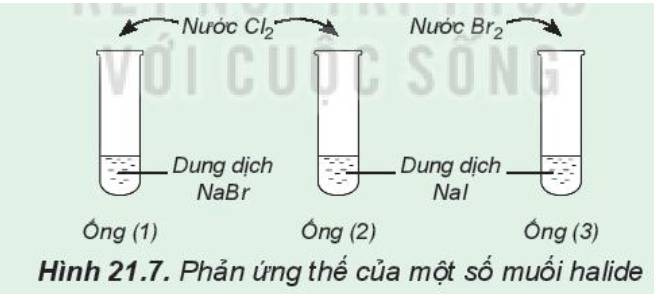
Quan sát sự thay đổi màu của dung dịch trong các ống nghiệm và trả lời câu hỏi:
1. Nhận xét sự thay đổi màu của dung dịch trong các ống nghiệm.
2. So sánh tính oxi hóa của Cl2, Br2, I2.
3. Hãy chọn một thuốc thử để chứng tỏ có sự tạo thành I2 khi cho nước chlorine (hoặc nước bromine) tác dụng với dung dịch sodium iodine.
Xét các phản ứng hóa học: H2(g) + X2(g) → 2HX(g) (X là các halogen)
Tra số liệu trong Bảng 12.2 để:
1. Giải thích xu hướng phản ứng của các đơn chất halogen với hydrogen theo khả năng hoạt động của các halogen
2. Dựa vào số liệu năng lượng liên kết H-X, giải thích xu hướng phản ứng giảm dần từ F2 đến I2

Tìm hiểu tính tẩy màu của khí chlorine ẩm
Tiến hành:
Đính một mẩu giấy màu ẩm vào thanh kim loại gắn với nút đậy bình tam giác. Sau đó, đưa mầu giấy vào bình tam giác chứa khí chlorine (Hình 21.6).
Quan sát hiện tượng và trả lời câu hỏi:
1. Nhận xét màu của mẩu giấy trước và sau khi cho vào bình tam giác. Giải thích
2. Xác định vai trò của chlorine trong phản ứng với nước, tại sao nói chlorine tự oxi hóa – tự khử trong phản ứng này?
Xác định số oxi hóa của chlorine trong các chất sau: Cl2, HCl, HClO, HClO2, HClO3, HClO4.
Tra cứu số liệu Bảng 6.1, Bảng 6.2 và Hình 6.2 để hoàn thành bảng mô tả một số đặc điểm cấu tạo của các nguyên tử halogen theo mẫu sau:
Nguyên tử | Lớp electron ngoài cùng | Bán kính nguyên tử | Độ âm điện |
Fluorine | ? | ? | ? |
Chlorine | ? | ? | ? |
Bromine | ? | ? | ? |
Iodine | ? | ? | ? |
Từ bảng số liệu thu được, hãy:
a) Giải thích tại sao nguyên tử halogen có xu hướng nhận 1 electron từ nguyên tử kim loại, hoặc góp chung 1 electron với nguyên tử phi kim, để hình thành liên kết.
b) Nêu và giải thích xu hướng biến đổi bán kính nguyên tử, độ âm điện của các nguyên tử halogen. Từ đó dự đoán xu hướng biến đổi tính oxi hóa từ F đến I
c) Dựa vào cấu hình electron lớp ngoài cùng và độ âm điện, giải thích tại sao nguyên tử fluorine chỉ có số oxi hóa -1 trong các hợp chất?
Thực hiện được thí nghiệm chứng minh và so sánh tính oxi hoá của đơn chất halogen.
Sử dụng nước Javel an toàn.
Viết phương trình hóa học minh họa tính oxi hóa giảm dần trong dãy Cl2, Br2, I2.
Khi sản xuất chlorine trong công nghiệp, NaOH và H2 được tạo thành ở cực âm, còn Cl2 được tạo thành từ cực dương. Tại sao cần sử dụng màng ngăn xốp để ngăn cách 2 điện cực?