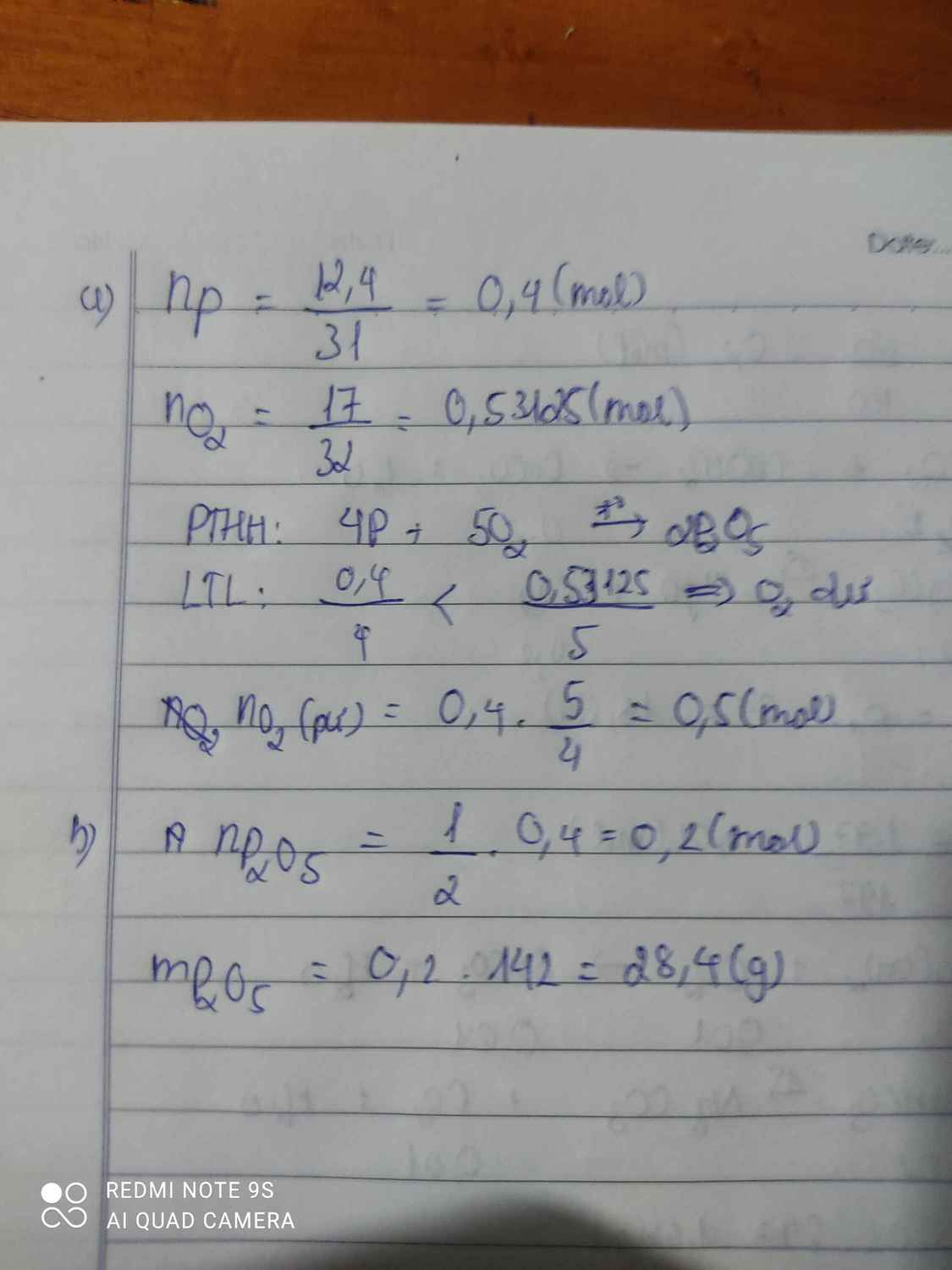\(1,n_P=\dfrac{12,4}{31}=0,4\left(mol\right)\\ n_{O_2}=\dfrac{17}{32}=0,53125\left(mol\right)\\ PTHH:4P+5O_2\rightarrow\left(t^o\right)2P_2O_5\\ Vì:\dfrac{0,4}{4}< \dfrac{0,53125}{5}\\ \Rightarrow P.hết,O_2dư\\ 2,Chất.tạo.thành:P_2O_5\\ n_{P_2O_5}=\dfrac{2}{4}.n_P=\dfrac{2.0,4}{4}=0,2\left(mol\right)\\ \Rightarrow m_P=0,2.142=28,4\left(g\right)\)
nP = 12,4/31 = 0,4 (mol).
Số mol oxi:
nO= 17/32= 0,53 (mol).
Phương trình phản ứng:
4P + 5O2 -> 2P2O5 0,4 0,5 0,2 (mol)
Vậy số mol oxi còn thừa lại là:
0,53 – 0,5 = 0,03 (mol).
2) Chất được tạo thành là P2O5.
Theo phương trình phản ứng, ta có:
nP2O5 = 1/2 nP= 1/2 x 0,4 = 0,2 (mol).
Khối lượng điphotpho pentaoxit tạo thành là:
m = 0,2.(31.2 + 16.5) = 28,4 gam