Dựa vào hình 8.2, nêu một số ứng dụng của hydrochloric acid.

Sử dụng Hình 8.2 để trình bày về một số ứng dụng của hydrochloric acid.

- Một số ứng dụng của hydrochloric acid:
+ Tẩy gỉ thép
+ Tổng hợp chất hữu cơ
+ Xử lí pH nước bể bơi
Dựa vào hình 8.3, nêu một số ứng dụng của sulfuric acid.
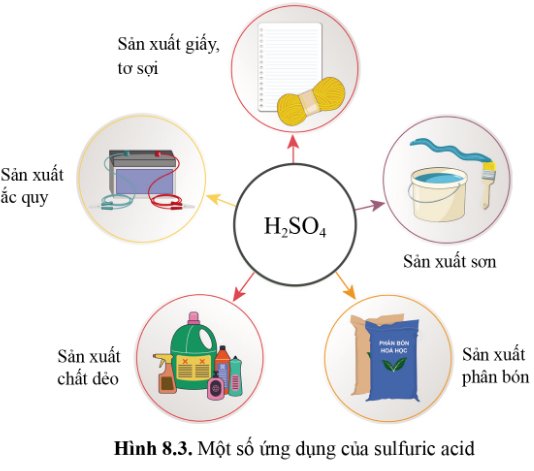
-Một số ứng dụng của axit sulfuric (H2SO4) như:
+ Sản xuất giấy tơ sợi.
+ Sản xuất ắc quy.
+ Sản xuất với chất dẻo.
+ Sản xuất phân bón.
+ Sản xuất chất sơn.
Dựa vào hình 8.4, nêu một số ứng dụng của acetic acid.

(nhìn hình là bt nha e :>)
-Một số ứng dụng của acetic acid (CH3COOH) như:
+ Sản xuất tơ nhân gạo.
+ Sản xuất thuốc diệt trừ sâu.
+ Sản xuất phẩm nhuộm.
+ Sản xuất dược phẩm.
+ Sản xuất chất dẻo.
Hydrochloric acid thường được dùng để đánh sạch lớp oxide, hydroxide, muối carbonate bám trên bề mặt kim loại trước khi sơn, hàn, mạ điện.
Ứng dụng này dựa trên tính chất hóa học nào của hydrochloric acid?
- Hydrochloric acid thường được dùng để đánh sạch lớp oxide, hydroxide, muối carbonate vì
+ HCl tác dụng với oxide, hydroxide → Muối + H2O
+ HCl tác dụng với muối carbonate → Muối mới + CO2 + H2O
ứng dụng này dựa trên tính axit của HCl(có thể tác dụng với dung dịch bazơ, bazơ, oxit bazơ)
Quan sát Hình 19.5, nêu một số ứng dụng của carboxylic acid.
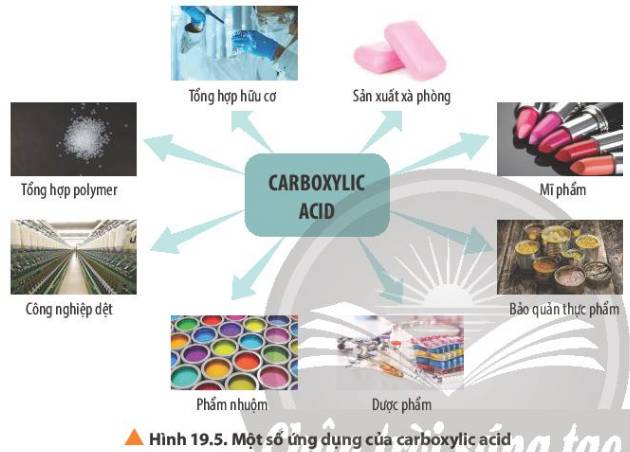
- Trong ngành may mặc, công nghiệp dệt
- Dùng làm phẩm nhuộm.
- Tổng hợp làm dược phẩm
- Bảo quản thực phẩm được lâu
- Dùng làm mĩ phẩm, phục vụ làm đẹp.
- Tổng hợp các polymer
- Sản xuất xà phòng (p.ứ xà phòng hoá)
- Tổng hợp hữu cơ.
-v.v.v....
Lập phương trình chữ của phản ứng dựa vào các thông tin sau:
1. Cho kim loại Sắt (Iron) phản ứng với Hydrochloric acid, sau phản ứng thu được muối Iron (II) Chloride và khí Hydrogen
2. Nung nóng thuốc tím (KMnO4) thu được chất Potassium manganate (K2MnO4), chất manganese dioxide (MnO2) và khí Oxygen
3. Cho Aluminium Oxide (Al2O3) tác dụng với Sulfurics Acid (H2SO4) thu được muối Aluminium Sulfate Al2(SO4) và nước
4. Magnessium tác dụng với Chlohiric Acid tạo thành Magnesium Chloride và Hydrogen
chỉ toii với
Cho một lượng bột zinc Zn vào dung dịch hydrochloric acid HCl thì phản ứng vừa đủ. Biết đã dùng 13 gam zinc. a) Tính khối lượng hydrochloric acid HCl phản ứng b) Tính thể tích khí hydrogen H2 (đkc) điều chế c) Dẫn toàn bộ lượng khí hydrogen thu được ở phản ứng trên qua bột iron (III) oxide đốt nóng thì phản ứng hoàn toàn. Tính khối lượng iron thu được
a, \(n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\)
PT: \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
_____0,2____0,4___________0,2 (mol)
\(\Rightarrow m_{HCl}=0,4.36,5=14,6\left(g\right)\)
b, \(V_{H_2}=0,2.24,79=4,958\left(l\right)\)
c, \(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
____________0,2__2/15 (mol)
\(\Rightarrow m_{Fe}=\dfrac{2}{15}.56=\dfrac{112}{15}\left(g\right)\)
Số mol của 13 gam Zn:
\(n_{Zn}=\dfrac{m}{M}=\dfrac{13}{65}=0,2\left(mol\right)\)
PTHH: \(Zn+2HCl\rightarrow ZnCl_2+H_2\uparrow\)
1 : 2 : 1 : 1 (g)
0,2\(\rightarrow\) 0,4 : 0,2 : 0,2 (mol)
a,Khối lượng của 0,4 mol HCl:
\(m_{HCl}=n.M=0,4.36,5=14,6\left(g\right)\)
b, Thể tích khí H2:
\(V_{H_2}=n.24,79=0,2.24,79=4,958\left(l\right)\)
\(3H_2+Fe_2O_3\underrightarrow{t^o}2Fe+3H_2O\)
Khối lượng của \(\dfrac{2}{15}\) mol Fe:
\(n_{Fe}=\dfrac{m}{M}=\dfrac{2}{\dfrac{15}{56}}\approx7,5\left(g\right)\)
Thí nghiệm chlorine phản ứng với hydrogen được mô tả như sau:
Bước 1: Chuẩn bị thí nghiệm như hình 17.1a với các ống nghiệm cùng đặt vào một giá thí nghiệm
Bước 2: Bơm vài giọt dung dịch hydrochloric acid (HCl) đặc từ xi – lanh chứa acid vào ống nghiệm chứa tinh thể potassium permanganate (thuốc tím, KMnO4) - ống nghiệm (1) để tạo khí chlorine. Khi pit – tông nâng lên khoảng ½ chiều cao của xi – lanh thu khí thì ngừng bơm acid (hình 17.1b)
Bước 3: Rút xi – lanh thu khí ra khỏi ống nghiệm (1), chuyển sang ghim vào ống nghiệm chứa kẽm - ống nghiệm (2) (hình 17.1c). Chuyển xi – lanh chứa dung dịch hydrochloric acid sang ống nghiệm (2)
Bước 4: Bơm vào giọt dung dịch hydrochloric acid từ xi – lanh chứa acid vào ống nghiệm (2) để tạo khí hydrogen. Đến khí pit – tông được nâng lên khoảng 2/3 xi – lanh thu khí thì ngừng bơm acid
Bước 5: Rút xi – lanh thu khí ra khỏi ống nghiệm (2). Ghim xi – lanh chứa hỗn hợp khí vào một nút cao su như hình 17.1d rồi kẹp vào giá thí nghiệm
Bước 6: Dùng đèn tử ngoại chiếu vào xi – lanh chứa hỗn hợp khí (hoặc dùng ngọn lửa hơ nhẹ bên ngoài xi – lanh)
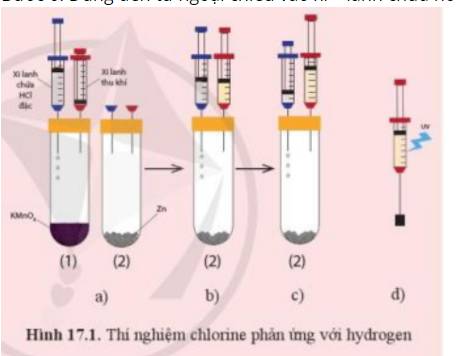
+ Quan sát và giải thích hiện tượng xảy ra khi dùng đèn tử ngoại chiếu vào xi – lanh chứa hỗn hợp khí (hoặc khi dùng ngọn lửa hơ nhẹ bên ngoài xi – lanh)
+ Nếu thay khí chlorine bằng hơi iodine thì phản ứng giữa hơi iodine và hydrogen có thể xảy ra hiện tượng như đã thấy trong thí nghiệm trên không? Giải thích
a)
- Ở Bước 2: Ta thu được khí chlorine
- Ở Bước 4: Ta thu được khí hydrogen
=> Trong xi – lanh là hỗn hợp kí chlorine và hydrogen
- Khi chiếu đèn tử ngoại vào xi – lanh hoặc dùng ngọn lửa hơ nhẹ bên ngoài xi - lanh chứa hỗn hợp khí chlorine và hydrogen sẽ gây ra hiện tượng nổ
- Phương trình hóa học: H2 + Cl2 → 2HCl
b) Nếu thay khí chlorine bằng hơi iodine thì phản ứng giữa hơi iodine và hydrogen không xảy ra hiện tượng như trên.
- Giải thích: Phản ứng giữa H2 và I2 cần đun nóng để phản ứng diễn ra, là phản ứng thuận nghịch, tạo hỗn hợp gồm HI sinh ra và lượng H2, I2 còn lại. Khả năng phản ứng kém nên không có hiện tượng nổ
H2 + I2 \( \rightleftharpoons \) 2HI
Nêu hiện tượng, viết pthh xảy ra trong các thí nghiệm sau:
1. cho 1 ít kẽm hạt vào ống nghiệm chứa dung dịch hydrochloric acid HCL
2. cho 2 ml dung dịch hydrochloric acid HCL vào ống nghiệm chứa đá vôi (Calcium carbonate),
1. Hiện tượng: Viên kẽm tan dần, có khí không màu thoát ra.
\(PTHH:Zn+2HCl--->ZnCl_2+H_2\uparrow\)
2. Hiện tượng: Viên đá vôi tan dần và có tỏa nhiệt, có khí không màu thoát ra.
\(PTHH:2HCl+CaCO_3--->CaCl_2+CO_2\uparrow+H_2O\)