1) cho 50ml dung dịch A gồm Na2CO3 1M và (NH4)2CO3 1,5M tác dụng vừa đủ với Ca(NO3)2 2M và Ba(OH)2 0,5M thu được m gam kết tủa và dung dịch C.
a) tính m
b) tính nồng độ các ion trong dung dịch C
Cho 200ml dung dịch Ca(OH)2 1M tác dụng hết với 250ml dung dịch Na2CO3 thu được kết tủa trắng. Tính nồng độ mol Na2CO3 đã dùng và m gam kết tủa.
Ta có: \(n_{Ca\left(OH\right)_2}=0,2.1=0,2\left(mol\right)\)
PT: \(Ca\left(OH\right)_2+Na_2CO_3\rightarrow CaCO_{3\downarrow}+2NaOH\)
_______0,2_______0,2________0,2 (mol)
\(\Rightarrow C_{M_{Na_2CO_3}}=\dfrac{0,2}{0,25}=0,8\left(M\right)\)
\(m_{CaCO_3}=0,2.100=20\left(g\right)\)
Giải giúp e vs ạ e cảm ơn
Bài 2: Cho 200ml dung dịch Na2CO3 1M tác dụng vừa đủ với 200 gam dung dịch Ba (OH) 2 . a. Viết PTHH xảy ra. b. Tính khối lượng chất kết tủa thu được. c. Tính nồng độ % của dung dịch Ba (OH) 2 dùng cho phản ứng trên.
a.
\(Na_2CO_3+Ba\left(OH\right)_2\rightarrow BaCO_3+2NaOH\)
b.
\(n_{BaCO_3}=n_{Na_2CO_3}=0,2.1=0,2\left(mol\right)\\ m_{kt}=197.0,2=39,4\left(g\right)\)
c.
\(n_{Ba\left(OH\right)_2}=n_{Na_2CO_3}=0,2\left(mol\right)\\ C\%_{Ba\left(OH\right)_2}=\dfrac{0,2.171.100\%}{200}=17,1\%\)
Cho 300ml dung dịch H3PO4 1M tác dụng với 300ml dung dịch Ca(OH)2 1M, sau phản ứng thu được m gam muối kết tủa và dung dịch B. Tính khối lượng kết tủa và nồng độ chất có trong B?
\(n_{Ca\left(OH\right)_2}=0,3\left(mol\right)\\ n_{H_3PO_4}=0,3\left(mol\right)\\ Vì:\dfrac{n_{Ca\left(OH\right)_2}}{n_{H_3PO_4}}=\dfrac{0,3}{0,3}=1\\ \Rightarrow Tạo.1.muối:CaHPO_4\\ Ca\left(OH\right)_2+H_3PO_4\rightarrow CaHPO_4+2H_2O\\ m_{\downarrow}=0\\ n_{CaHPO_4}=n_{Ca\left(OH\right)_2}=0,3\left(mol\right)\\ C_{MddCaHPO_4}=\dfrac{0,3}{0,3+0,3}=0,5\left(M\right)\)
Cho 100 ml dung dịch gồm Ba(OH)2 0,1M và NaOH 0,1M với 400 ml dung dịch gồm H2SO4 0,0175M, thu được m gam kết tủa và dung dịch (X)
a/ Tính m và nồng độ các ion có trong dung dịch (X)
b/ pH trong dung dịch (X)a, \(n_{Ba\left(OH\right)_2}=0,1.0,1=0,01\left(mol\right)=n_{Ba^{2+}}\)
\(\Rightarrow n_{OH^-}=2n_{Ba\left(OH\right)_2}=0,02\left(mol\right)\)
\(n_{NaOH}=0,1.0,1=0,01\left(mol\right)=n_{Na^+}=n_{OH^-}\)
⇒ ΣnOH- = 0,02 + 0,01 = 0,03 (mol)
\(n_{H_2SO_4}=0,4.0,0175=0,007\left(mol\right)=n_{SO_4^{2-}}\)
\(\Rightarrow n_{H^+}=2n_{H_2SO_4}=0,014\left(mol\right)\)
\(H^++OH^-\rightarrow H_2O\)
0,014___0,014 (mol) ⇒ nOH- dư = 0,03 - 0,014 = 0,016 (mol)
\(Ba^{2+}+SO_4^{2-}\rightarrow BaSO_4\)
0,007____0,007_____0,007 (mol) ⇒ nBa2+ dư = 0,01 - 0,007 = 0,003 (mol)
⇒ m = 0,007.233 = 1,631 (g)
\(\left[OH^-\right]=\dfrac{0,016}{0,1+0,4}=0,032\left(M\right)\)
\(\left[Ba^{2+}\right]=\dfrac{0,003}{0,1+0,4}=0,006\left(M\right)\)
\(\left[Na^+\right]=\dfrac{0,01}{0,1+0,4}=0,02\left(M\right)\)
b, pH = 14 - (-log[OH-]) ≃ 12,505
\(n_{Ba^{2+}}=0,1.0,1=0,01\left(mol\right)\)
\(n_{SO_4^{2-}}=0,4.0,0175=7.10 ^{-3}\left(mol\right)\)
\(Ba^{2+}+SO_4^{2-}\rightarrow BaSO_4\downarrow\)
\(\Rightarrow m=m_{BaSO_4}=7.10^{-3}.233=1,631\left(g\right)\)
Ta có:
\(n_{H^+}=0,4.0,0175.2=0,014\left(mol\right)\)
\(n_{OH^-}=0,1.0,1.2+0,1.0,1=0,03\left(mol\right)\)
Trong dung dịch X:
\(n_{OH^-}=0,03-0,014=0,016\left(mol\right)\)\(\Rightarrow\left[OH^-\right]=\dfrac{0,016}{0,1+0,4}=0,032\left(M\right)\)
\(n_{Ba^{2+}}=0,01-7.10^{-3}=3.10^{-3}\left(mol\right)\Rightarrow\left[Ba^{2+}\right]=\dfrac{3.10^{-3}}{0,1+0,4}=6.10^{-3}\left(M\right)\)
\(n_{Na^+}=0,1.0,1=0,01\left(mol\right)\Rightarrow\left[Na^+\right]=0,02\)
\(pOH=-lg\left(0,032\right)\approx1,5\Rightarrow pH=14-1,5=12,5\)
Hòa tan m gam Fe vào 300 ml dung dịch H2SO4 0,5M thu được dung dịch X và V1 lít H2 ở đktc. Cho dung dịch X tác dụng vừa đủ với V2 ml dung dịch Ba(OH)2 1M thu được 41,7 gam kết tủa. Tính m, V1, V2.
PTHH: \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\uparrow\)
\(FeSO_4+Ba\left(OH\right)_2\rightarrow BaSO_4\downarrow+Fe\left(OH\right)_2\downarrow\)
Ta có: \(n_{H_2SO_4}=0,3\cdot0,5=0,15\left(mol\right)=n_{Fe}=n_{H_2}=n_{Ba\left(OH\right)_2}\)
\(\Rightarrow\left\{{}\begin{matrix}m_{Fe}=0,15\cdot56=8,4\left(g\right)\\V_{H_2}=0,15\cdot22,4=3,36\left(l\right)\\V_{Ba\left(OH\right)_2}=\dfrac{0,15}{1}=0,15\left(l\right)=150\left(ml\right)\end{matrix}\right.\)
*Bạn xem lại đề vì nếu FeSO4 p/ứ hết thì sẽ có nhiều hơn 41,7 gam kết tủa
Cho từ từ 150 ml dung dịch HCl 1M vào 500 ml dung dịch A gồm Na2CO3 và NaHCO3 thì thu được 1,008 lít khí (đktc) và dung dịch B. Cho dung dịch B tác dụng với dung dịch Ba(OH)2 dư thì thu được 29,55 gam kết tủa. Nồng độ mol của Na2CO3 và NaHCO3 trong dung dịch A lần lượt là:
A. 0,21M và 0,18M
B. 0,18M và 0,26M
C. 0,2M và 0,4M
D. 0,21M và 0,32M
Đáp án A
Có n H C l = 0 , 15 ; n C O 2 = 0 , 045 ; n B a C O 3 = 0 , 15
Gọi n N a 2 C O 3 = a ; n N a H C O 3 = b
Các phản ứng xảy ra theo thứ tự sau:
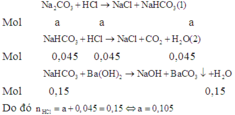
Áp dụng định luật bảo toàn nguyên tố C, ta có:
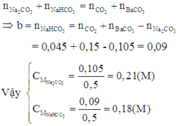
Cho từ từ 150 ml dung dịch HCl 1M vào 500 ml dung dịch A gồm Na2CO3 và NaHCO3 thì thu được 1,008 lít khí (điều kiện chuẩn) và dung dịch B. Cho dung dịch B tác dụng với dung dịch Ba(OH)2 dư thì thu được 29,55 gam kết tủa. Nồng độ mol của Na2CO3 và NaHCO3 trong dung dịch A lần lượt là:
A. 0,18M và 0,26M
B. 0,21M và 0,18M
C. 0,21M và 0,32M
D. 0,2M và 0,4M
Đáp án B
Ta có: nHCl = 0,15 mol; n C O 2 = 1,008/22,4 = 0,045 mol.
Giả sử ban đầu có x mol NaHCO3
CO32- + H+ → HCO3- (1)
HCO3-+ H+ → CO2+ H2O (2)
0,045 0,045 ←0,045
Theo PT (2): n H C O 3 - = n H + = n C O 2 = 0,045 mol
→ n H + PT1 = 0,15- 0,045= 0,105 mol
→ n C O 3 2 - PT1 = n H + = n H C O 3 - PT1 = 0,105 mol
→ n N a 2 C O 3 = n C O 3 2 - PT1= 0,105 mol
→ C M N a 2 C O 3 = 0,105/ 0,5 = 0,21M
Dung dịch Y chứa Na+, HCO3- dư:
x+0,105- 0,045 = x+0,06 mol
HCO3-+ OH- → CO32-+ H2O
Ba2++ CO32- → BaCO3
Ta thấy: n H C O 3 - = n C O 3 2 - = n B a C O 3 = 29,55/197 = 0,15 mol
→ x+0,06 = 0,15
→ x = 0,09 mol → C M N a H C O 3 = 0,09/ 0,5 = 0,18M
Trộn 100ml dung dịch HCL 1M với 100 ml dung dịch H2So4 0,5m thu được dung dịch D.
a. Tính nồng độ các ion trong dung dịch D.
b. Cho dung dịch D tác dụng vừa đủ với V ml dung dịch Ba(oh)2. Tính V.
\(n_{HCl}=Cm.V=1.0,1=1mol\)
\(n_{H_2SO_4}=Cm.V=0,5.0,1=0,05mol\)
Thể thích của dd D là 200ml = 0,2l
\([H^+]=\frac{n_{HCl}+2.n_{H_2SO_4}}{V}=\frac{0,1+0,1}{0,2}=1M\)
\([Cl^-]=\frac{n_{HCl}}{V}=\frac{0,1}{0,2}=0,5M\)
\([SO_4^{2-}]=\frac{n_{H_2SO_4}}{V}=\frac{0,05}{0,2}=0,25M\)
Khi cho dd D vào \(Ba\left(OH\right)_2\) chỉ có \(H_2SO_4\) tác dụng, tạo kết tủa
\(H_2SO_4+Ba\left(OH\right)_2\rightarrow BaSO_4+2H_2O\)
\(0,05....\rightarrow0,05mol\)
\(\rightarrow m_{BaSO_4}=n.M=0,05.233=11,65g\)
Cho từ từ 150 ml dd HCl 1M vào 500 ml dung dịch A gồm Na2CO3 và NaHCO3 thì thu được 1.008 lít khí (điều kiện tiêu chuẩn) và dung dịch B. Cho dung dịch B tác dụng với dung dịch Ba(OH)2 dư thì 2 thu được 29.55 gam kết tủa. Nồng độ mol của Na2CO3 và NaHCO3 trong dung dịch A lần lượt là:
A. 0.18M và 0.26M
B. 0.21M và 0.18M
C. 0.21M và 0.32M
D. 0.2M và 0.4M