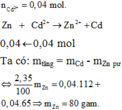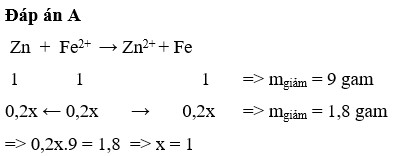Ngâm một lá kẽm có khối lượng 5g trong 180g dd muối nitrat của kim loại R nồng độ 20% . Sau khi pư kết thúc , lấy kẽm ra , rửa nhẹ , làm khô , cân lại thấy khối lượng lá kẽm giảm 4% so với khối lượng ban đầu . Xđ kim loại R

Những câu hỏi liên quan
Ngâm 1 lá kẽm trong 500ml dung dịch pb(no3)2 nồng độ 2M. Sau 1 thời gian lấy lá kẽm ra rửa cẩn thận làm khô, cân lại thì thấy nặng hơn so vs ban đầu 1,42g.
a) Hãy tính khối lượng chì bám vào lá kẽm.
b) nồng độ mol của dd sau khi lấy lá kẽm ra.
PTHH: Zn + Pb(NO3)2 → Zn(NO3)2 + Pb
(Gọi số mol của Zn là a => Số mol của Pb là a)
Sau 1 thời gian lấy lá kẽm ra thấy khối lượng tăng 1,42 gam = Khối lượng Pb sinh ra bám vào lá kẽm trừ đi khối lượng Zn phản ứng.
<=> 207a - 65a = 1,42
<=> a = 0,01 (mol)
a) Khối lượng chì bám vào kẽm là: 207a = 2,07(g)
b) Đổi: 500 ml = 0,5 l
Số mol của dung dịch Pb(NO3)2 là: 0,5 . 2 = 1 (mol)
So sánh: 0,01 < 1
=> Dung dịch Pb(NO3)2 dư , tính theo Zn
Số mol của Zn(NO3)2 là: 0,01 . 1 = 0,01 (mol)
Nồng độ mol của dung dịch sau khi lấy lá kẽm ra là:
CM = n / V = 0,01 : 0,5 = 0,02M
( Vì thể tích dung dịch k thay đổi đáng kể nên sau phản ứng và lấy lá kẽm ra thì thể tích dung dịch vẫn là 500 ml)
Đúng 0
Bình luận (0)
PTHH: Zn + Pb(NO3)2 → Zn(NO3)2 + Pb
(Gọi số mol của Zn là a => Số mol của Pb là a)
Sau 1 thời gian lấy lá kẽm ra thấy khối lượng tăng 1,42 gam = Khối lượng Pb sinh ra bám vào lá kẽm trừ đi khối lượng Zn phản ứng.
<=> 207a - 65a = 1,42
<=> a = 0,01 (mol)
a) Khối lượng chì bám vào kẽm là: 207a = 2,07(g)
b) Đổi: 500 ml = 0,5 l
Số mol của dung dịch Pb(NO3)2 là: 0,5 . 2 = 1 (mol)
So sánh: 0,01 < 1
=> Dung dịch Pb(NO3)2 dư , tính theo Zn
Số mol của Zn(NO3)2 là: 0,01 . 1 = 0,01 (mol)
Nồng độ mol của dung dịch sau khi lấy lá kẽm ra là:
CM = n / V = 0,01 : 0,5 = 0,02M
( Vì thể tích dung dịch k thay đổi đáng kể nên sau phản ứng và lấy lá kẽm ra thì thể tích dung dịch vẫn là 500 ml)
chúc bạn học tốt và nhớ tích đúng cho mình
Đúng 0
Bình luận (0)
Ngâm một lá kẽm vào dung dịch có hoà tan 8,32 gam CdSO4. Phản ứng xong lấy lá kẽm ra khỏi dung dịch, rửa nhẹ, làm khô thì thấy khối lượng lá kẽm tăng thêm 2,35% so với khối lượng lá kẽm trước phản ứng. Khối lượng lá kẽm trước phản ứng là: A. 80 gam. B. 60 gam C. 20 gam D. 40 gam
Đọc tiếp
Ngâm một lá kẽm vào dung dịch có hoà tan 8,32 gam CdSO4. Phản ứng xong lấy lá kẽm ra khỏi dung dịch, rửa nhẹ, làm khô thì thấy khối lượng lá kẽm tăng thêm 2,35% so với khối lượng lá kẽm trước phản ứng. Khối lượng lá kẽm trước phản ứng là:
A. 80 gam.
B. 60 gam
C. 20 gam
D. 40 gam
Ngâm một kẽm trong 25,5 g dung dịch muối bạc natri 20% cho đến khi phản ứng kết thúc
a,Tính khối lượng kẽm đã phản ứng
b,lấy lá kẽm ra khỏi dung dịch , làm khô. Hỏi khối lượng lá kẽm tăng hay giảm
Cho lá kẽm có khối lượng 25 gam vào dung dịch đồng sunfat. Sau khi phản ứng kết thúc, đem tấm kim loại ra rửa nhẹ, làm khô cân được 24,96 gam. Tính khối lượng kẽm đã phản ứng.
Dạng bài toán cho kim loại mạnh đẩy kim loại yếu ra khỏi dung dịch muối của chúng có hai trường hợp sau
+ Nếu đề bài cho khối lượng thanh kim loại tăng, lập phương trình đại số :
m kim loại giải phóng - m kim loại tan = m kim loại tăng
+ Nếu đề bài cho khối lượng thanh kim loại giảm, lập phương trình đại số :
m kim loại tan - m kim loại giải phóng = m kim loại giảm
Gọi x là số mol Zn tham gia
65x - 64x = 25 - 24,96 => x = 0,04 mol
m Zn p / u = 0,04 x 65 = 2,6 g
Đúng 0
Bình luận (0)
cho lá zn có khối lượng 25g vào dd cuso4 sau phản ứng đem tấm kim loại ra rửa nhẹ, làm khô, cân nặng được 24,96g
a)viết pthh
b)tại sao khối lượng kẽm giảm? gọi x là mol kẽm đã phản ứng, tính khối lượng kẽm tan và đồng bám vào lá kim loại theo x
c) tính khối lượng kẽm tham gia pu
d) tính khối lượng CUSO4 trong dd
\(a.Zn+CuSO_4->ZnSO_4+Cu\)
b. m Zn giảm vì sau phản ứng tạo Cu (M = 64), M(Cu) < M(Zn) = 65 nên khối lượng lá Zn tăng.
\(m_{Zn\left(Pư\right)}=65x\left(g\right)\\ m_{Cu}=64x\left(g\right)\\c.\Delta m_{rắn}=25-24,96=65x-64x\\ x=0,04mol\\ m_{Zn\left(Pư\right)}=65x=2,6g< 25g\Rightarrow Zn:hết\\d. n_{CuSO_4}=160x=6,4g\)
Đúng 1
Bình luận (1)
Ngâm 1 thành kẽm có khối lượng là 50 (g) vào V(ml) hỗn hợp cuso4 1M, agno3 4M sau khi kẽm ko tan được nữa lấy lá kẽm ra rửa nhẹ làm khô còn thấy khối lượng lá kẽm là 52,92g. Tính V
Để tính V, ta sẽ sử dụng công thức nồng độ (C) và thể tích (V) của dung dịch. Ta có thể sử dụng công thức sau:
C1V1 = C2V2
Trong đó:
C1 là nồng độ của dung dịch CuSO4 ban đầu (1M)V1 là thể tích của dung dịch CuSO4 ban đầu (chưa có kẽm) (chưa biết)C2 là nồng độ của dung dịch CuSO4 sau khi kẽm không tan được nữa (1M)V2 là thể tích của dung dịch CuSO4 sau khi kẽm không tan được nữa (chưa biết)Ta cũng biết rằng khối lượng của lá kẽm sau khi rửa và làm khô là 52,92g.
Từ đó, ta có thể tính được thể tích của dung dịch CuSO4 ban đầu (V1) như sau:
V1 = (C2V2) / C1
Với C2 = 1M và C1 = 1M, ta có:
V1 = V2
Vậy, thể tích của dung dịch CuSO4 ban đầu (V1) cũng chính là thể tích của dung dịch CuSO4 sau khi kẽm không tan được nữa (V2).
Tuy nhiên, từ đề bài không cung cấp thông tin về thể tích của dung dịch CuSO4 sau khi kẽm không tan được nữa (V2), nên không thể tính được thể tích của dung dịch CuSO4 ban đầu (V1).
Đúng 0
Bình luận (0)
Cho một lá kẽm có khối lượng 50g vào dung dịch CuSO4. Sau khi phản ứng kết thúc, đem lá kẽm ra rửa nhẹ, làm khô, cân được 49.82 gam. Hãy tính khối lượng CuSO4 trong dung dịch.
Gọi x là số mol Zn p.ứ
Zn + CuSO4 = ZnSO4 + Cu
x x x (mol)
Vì khi phản ứng Zn tác dụng với CuSO4 và Cu bám trên bề mặt lá kẽm nên sau phản ứng ta thu được 49,82g khối lượng chất rắn gồm Zn dư và Cu
Ta có: 65x - 64x = 50 - 49,82 = 0,18(g)
=> x = 0,18 (mol)
Khối lượng CuSO4 trong dung dịch là
0,18 x 160 = 28,8 (g)
Đúng 0
Bình luận (0)
4. Ngâm một lá kẽm có khối lượng 25 gam trong 300 ml dung dịch CuCl2 20% có khối lượng riêng là 1,2 g/ml. Sau một thời gian phản ứng, người ta lấy lá kẽm ra khỏi dung dịch , rủa nhẹ, làm khô thì cân nặng 18 gam. Tính nồng độ phần trăm của các chất trong dung dịch sau phản ứng.
Ngâm một thanh kẽm trong 200 ml dung dịch F e S O 4 xM. Sau khi phản ứng kết thúc lấy thanh kẽm ra khỏi dung dịch rửa nhẹ, làm khô thấy khối lượng thanh kẽm giảm 1,8 gam. Giá trị của x là
A. 1,000
B. 0,001
C. 0,040
D. 0,200