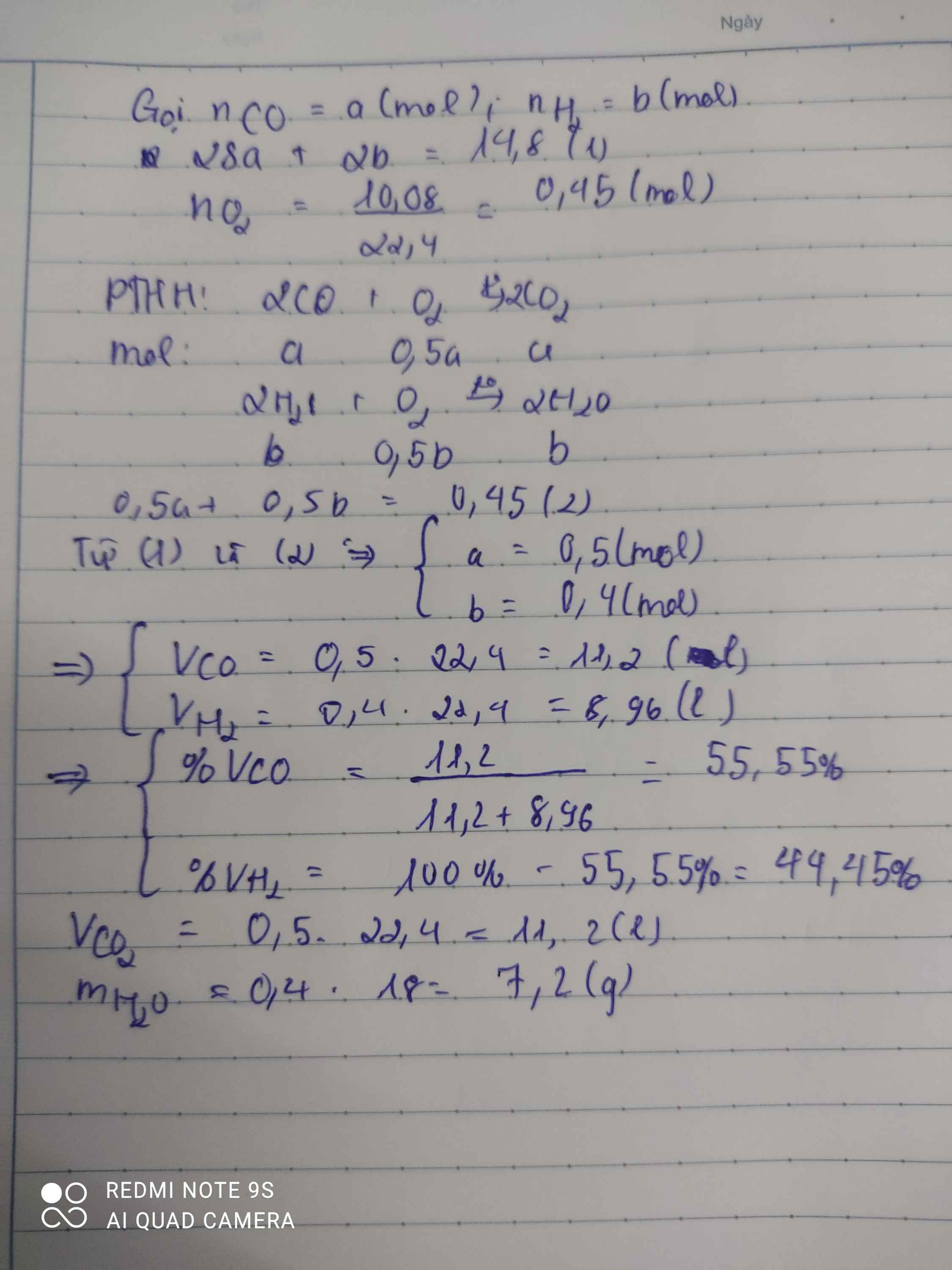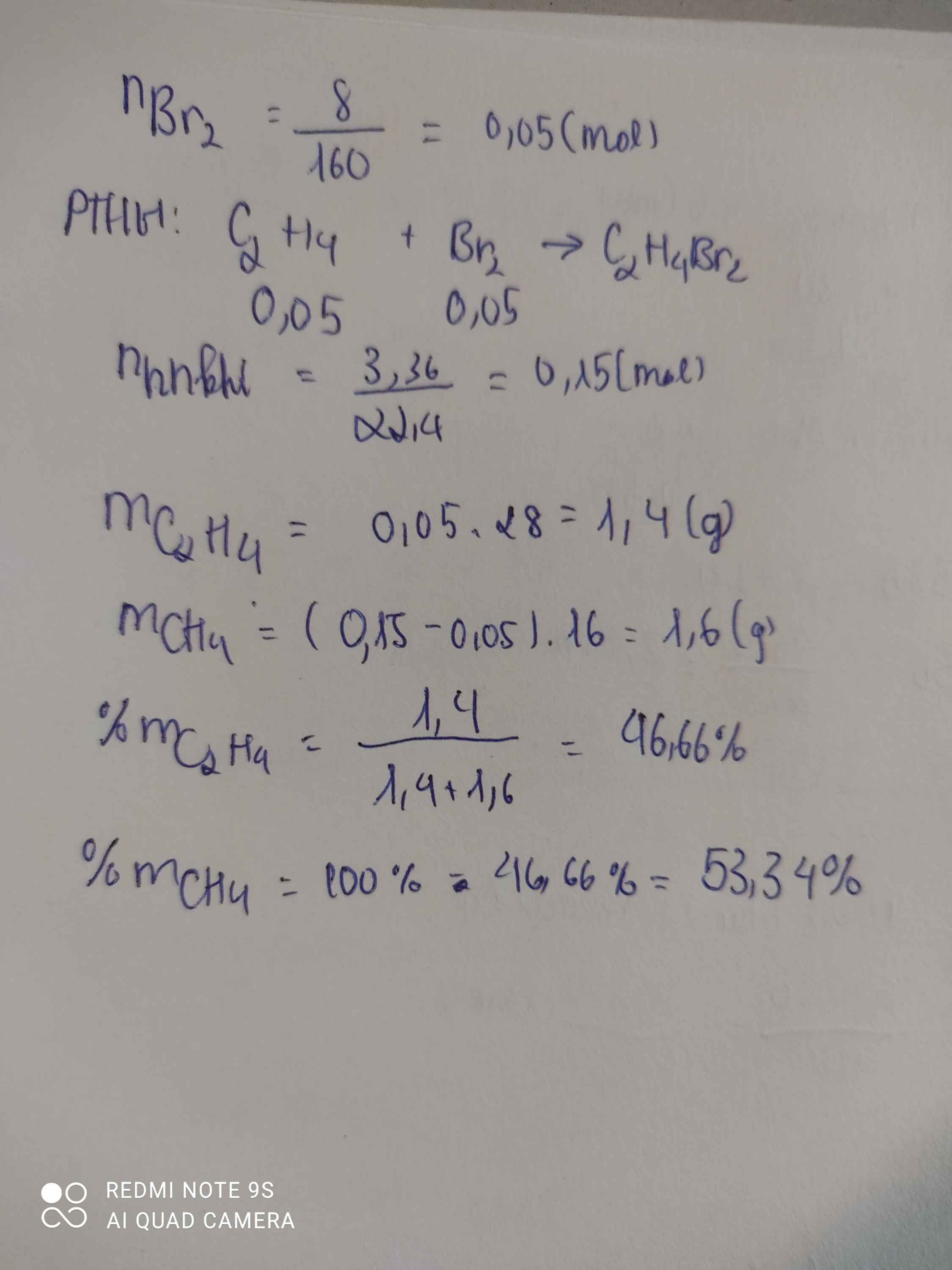Đốt cháy hoàn toàn 7,3g hỗn hợp khí H2 và CO cần dùng 22,4l không khí ở đktc. Xác định thành phần % về khói lượng các chất

Những câu hỏi liên quan
Đốt cháy hoàn toàn 14,8 g hỗn hợp khí gồm CO và H2 cần dùng 10,08 l khí O2 Tính:
a. Thành phần % về thể tích mỗi khí trong hỗn hợp ban đầu(đktc)
b. Thể tích khí CO2 và khối lượng nước thu được(đktc)
Đốt cháy hoàn toàn 1 hỗn hợp khí gồm CO và H2 cần dùng 6,72L O2 . Khí sinh ra có 4,48L khí CO2 . Biết các khí ở ĐKTC . Tính thành phần trăm theo thể tích của các khí trong hỗn hợp
nO2(tổng)=0,3(mol); nCO2=0,2(mol)
CO + 1/2 O2 -to-> CO2 (1)
0,2<----0,1<-------0,2(mol)
H2 + 1/2 O2 -to-> H2O (2)
0,4<---0,2<-------0,4(mol)
nO2(2)= nO2(tổng)- nO2(1)=0,3-0,1=0,2(mol)
Vì số mol tỉ lệ thuận thể tích:
=> %V(CO/hh)= [0,2/(0.2+0,4)].100=33,333%
=>%V(H2/hh)=100%-33,333%=66,667%
Đúng 2
Bình luận (0)
Cho 3,36 lít hỗn hợp etilen và metan (đktc) vào dung dịch brom dư thấy có 8 gam brom tham
gia phản ứng.
a. Xác định thành phần phần trăm khối lượng các khí trong hỗn hợp.
b. Tính thể tích khí O2 cần dùng ở đktc nếu đốt cháy hoàn toàn hỗn hợp khí trên.
a)
\(n_{Br_2}=\dfrac{8}{160}=0,05\left(mol\right)\)
PTHH: C2H4 + Br2 --> C2H4Br2
0,05<-0,05
=> \(n_{CH_4}=\dfrac{3,36}{22,4}-0,05=0,1\left(mol\right)\)
\(\%m_{CH_4}=\dfrac{0,1.16}{0,1.16+0,05.28}.100\%=53,33\%\)
\(\%m_{C_2H_4}=\dfrac{0,05.28}{0,1.16+0,05.28}.100\%=46,67\%\)
b)
PTHH: CH4 + 2O2 --to--> CO2 + 2H2O
0,1-->0,2
C2H4 + 3O2 --to--> 2CO2 + 2H2O
0,05--->0,15
=> \(V_{O_2}=\left(0,2+0,15\right).22,4=7,84\left(l\right)\)
Đúng 2
Bình luận (0)
Bài 4. Đốt cháy hoàn toàn 68g hỗn hợp X (hiđro và cacbon oxit) cần dùng 89,6 lít oxi.
a/. Tính thành phần % về khối lượng và % về thể tích của mỗi khí trong X? (khí ở đktc).
b/. Bằng phương pháp hoá học hãy nhận biết mỗi khí H2 và CO riêng biệt.
a. Gọi số mol của H2, CO lần lượt là a,b.
\(\Rightarrow2a+28b=68\left(1\right)\)
\(n_{O_2\left(đktc\right)}=\dfrac{V}{22,4}=\dfrac{89,6}{22,4}=4\left(mol\right)\)
\(2H_2+O_2\rightarrow^{t^0}2H_2O\)
2 : 1 (mol)
a : \(\dfrac{a}{2}\) (mol)
\(2CO+O_2\rightarrow^{t^0}2CO_2\)
2 : 1 (mol)
b : \(\dfrac{b}{2}\) (mol)
\(\Rightarrow\dfrac{a+b}{2}=4\left(2\right)\)
-Từ (1) và (2) suy ra: \(b=2;a=6\)
\(\%m_{H_2}=\dfrac{2a}{68}.100\%=\dfrac{2.6}{68}.100\%\approx17,65\%\)
\(\%m_{CO}=\dfrac{28b}{68}.100\%=\dfrac{28.2}{68}.100\%\approx82,35\%\)
\(V_{H_2}=n.22,4=6.22,4=134,4\left(l\right)\)
\(V_{CO}=n.22,4=2.22,4=44,8\left(l\right)\)
\(\%V_{H_2}=\dfrac{134,4}{134,4+44,8}.100\%=75\%\)
\(\%V_{CO}=\dfrac{44,8}{134,4+44,8}.100\%=25\%\)
Đúng 1
Bình luận (0)
đề có nhầm gì không vậy 68g thì lượng oxi quá ít.-.
Đúng 0
Bình luận (2)
Bài 4. Đốt cháy hoàn toàn 68g hỗn hợp X (hiđro và cacbon oxit) cần dùng 89,6 lít oxi.
a/. Tính thành phần % về khối lượng và % về thể tích của mỗi khí trong X? (khí ở đktc).
b/. Bằng phương pháp hoá học hãy nhận biết mỗi khí H2 và CO riêng biệt.
a)
Gọi số mol H2, CO là a, b (mol)
=> 2a + 28b = 68 (1)
\(n_{O_2}=\dfrac{89,6}{22,4}=4\left(mol\right)\)
PTHH: 2H2 + O2 --to--> 2H2O
a--->0,5a
2CO + O2 --to--> 2CO2
b--->0,5b
=> 0,5a + 0,5b = 4 (2)
(1)(2) => a = 6 (mol); b = 2 (mol)
\(\left\{{}\begin{matrix}\%m_{H_2}=\dfrac{6.2}{68}.100\%=17,647\%\\\%m_{CO}=\dfrac{2.28}{68}.100\%=82,353\%\end{matrix}\right.\)
\(\left\{{}\begin{matrix}\%V_{H_2}=\dfrac{6}{2+6}.100\%=75\%\\\%V_{CO}=\dfrac{2}{2+6}.100\%=25\%\end{matrix}\right.\)
b) Đốt cháy 2 khí trong O2 dư, dẫn sản phẩm thu được qua dd Ca(OH)2 dư:
+ Không hiện tượng: H2
2H2 + O2 --to--> 2H2O
+ Kết tủa trắng: CO
2CO + O2 --to--> 2CO2
CO2 + Ca(OH)2 --> CaCO3 + H2O
Đúng 2
Bình luận (0)
Đốt cháy hoàn toàn hỗn hợp gồm CO và H2 cần phải dùng 3,36 lít khí oxi ở đktc và thu được 1,8g nước.
a) Tính thể tích mỗi chất trong hỗn hợp ban đầu
b) Tính khối lượng CO2 tạo thành
a)
\(n_{O_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
\(n_{H_2O}=\dfrac{1,8}{18}=0,1\left(mol\right)\)
PTHH: 2H2 + O2 --to--> 2H2O
0,1<-0,05<-------0,1
2CO + O2 --to--> 2CO2
0,2<--0,1-------->0,2
=> \(\left\{{}\begin{matrix}V_{H_2}=0,1.22,4=2,24\left(l\right)\\V_{CO}=0,2.22,4=4,48\left(l\right)\end{matrix}\right.\)
b) \(m_{CO_2}=0,2.44=8,8\left(g\right)\)
Đúng 3
Bình luận (0)
\(n_{O_2}=\dfrac{3,36}{22,4}=0,15mol\)
\(n_{H_2O}=\dfrac{1,8}{18}=0,1mol\)
\(2CO+O_2\rightarrow2CO_2\)
a 0,5a a
\(2H_2+O_2\rightarrow2H_2O\)
0,1 0,05 \(\leftarrow\) 0,1
\(\Sigma n_{O_2}=0,5a+0,05=0,15\)
\(\Rightarrow a=n_{O_2\left(CO\right)}=0,2mol\)
\(V_{CO}=2\cdot0,2\cdot22,4=8,96l\)
\(V_{H_2}=0,1\cdot22,4=2,24l\)
\(m_{CO_2}=0,2\cdot44=8,8g\)
Đúng 2
Bình luận (0)
Đốt cháy hoàn toàn một hỗn hợp khí gồm có CO và H2 cần dùng 6,72 lit khí O2. Khí sinh ra có 4,48 lit khí CO2. Hãy tính thành phần % của hỗn hợp khí ban đầu theo thể tích hỗn hợp( các thể tích khí đều đo ở cùng đktc)
\(n_{O_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\\ n_{CO_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PTHH:
2CO + O2 --to--> 2CO2
0,2<---0,1<--------0,2
2H2 + O2 --to--> 2H2O
0,4<--0,2<-------0,2
\(\Rightarrow\left\{{}\begin{matrix}\%V_{CO}=\dfrac{0,2}{0,2+0,4}.100\%=33,33\%\\\%V_{H_2}=100\%-33,33\%=66,67\%\end{matrix}\right.\)
Đúng 1
Bình luận (0)
\(n_{CO_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\\ n_{O_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PTHH: 2CO + O2 --to--> 2CO2
0,3<--0,15<------0,3
2H2 + O2 --to--> 2H2O
0,1<--0,05
\(\Rightarrow\left\{{}\begin{matrix}\%V_{CO}=\%n_{CO}=\dfrac{0,3}{0,3+0,1}.100\%=75\%\\\%V_{H_2}=100\%-75\%=25\%\end{matrix}\right.\)
Câu 4: Đốt cháy một hỗn hợp gồm CH4 và C2H2 có thể tích là 33,6 lít (đktc) thu được 56 lít khí CO2 (đktc).a. Xác định thành phần % về thể tích các khí trong hỗn hợp?b. Tính khối lượng của oxi cần để đốt cháy hoàn toàn hỗn hợp khí trên?
Đọc tiếp
Câu 4: Đốt cháy một hỗn hợp gồm CH4 và C2H2 có thể tích là 33,6 lít (đktc) thu được 56 lít khí CO2 (đktc).
a. Xác định thành phần % về thể tích các khí trong hỗn hợp?
b. Tính khối lượng của oxi cần để đốt cháy hoàn toàn hỗn hợp khí trên?
a, \(CH_4+2O_2\underrightarrow{t^o}CO_2+H_2O\)
\(2C_2H_2+5O_2\underrightarrow{t^o}4CO_2+2H_2O\)
Ta có: \(n_{CH_4}+n_{C_2H_2}=\dfrac{33,6}{22,4}=1,5\left(mol\right)\left(1\right)\)
Theo PT: \(n_{CO_2}=n_{CH_4}+2n_{C_2H_2}=\dfrac{56}{22,4}=2,5\left(mol\right)\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{CH_4}=0,5\left(mol\right)\\n_{C_2H_2}=1\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%V_{CH_4}=\dfrac{0,5.22,4}{33,6}.100\%\approx33,33\%\\\%V_{C_2H_2}\approx66,67\%\end{matrix}\right.\)
b, Theo PT: \(n_{O_2}=2n_{CH_4}+\dfrac{5}{2}n_{C_2H_2}=3,5\left(mol\right)\Rightarrow m_{O_2}=3,5.32=112\left(g\right)\)
Đúng 3
Bình luận (1)
Bài 5. Đốt cháy hoàn toàn một hỗn hợp khí gồm CO và H2 cần dùng 9,6g khí oxi. Khí sinh ra có 8,8g CO2.
a. Viết PTHH xảy ra.
b. Tính khối lượng và thành phần % về khối lượng mỗi chất trong hỗn hợp khí ban đầu.
c) Để thu được 9,6 gam khí O2 thì cần nhiệt phân bao nhiêu gam KMnO4?
Xem chi tiết
a) PTHH: \(2CO+O_2\underrightarrow{t^o}2CO_2\) (1)
\(4H_2+O_2\underrightarrow{t^o}2H_2O\) (2)
b) Ta có: \(\left\{{}\begin{matrix}\Sigma n_{O_2}=\dfrac{9,6}{32}=0,3\left(mol\right)\\n_{CO_2}=\dfrac{8,8}{44}=0,2\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}n_{O_2\left(1\right)}=0,1mol\\n_{O_2\left(2\right)}=0,2mol\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{CO}=0,1\cdot28=2,8\left(g\right)\\m_{H_2}=0,2\cdot2=0,4\left(g\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}\%m_{CO}=\dfrac{2,8}{2,8+0,4}\cdot100\%=87,5\%\\\%m_{H_2}=12,5\%\end{matrix}\right.\)
c) PTHH: \(2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\uparrow\)
Theo PTHH: \(n_{KMnO_4}=2n_{O_2}=0,6mol\)
\(\Rightarrow m_{KMnO_4}=0,6\cdot158=94,8\left(g\right)\)
Đúng 2
Bình luận (0)
Đốt cháy hoàn toàn 10g hỗn hợp khí ở đktc gồm CH4 và H2 bằng khí Oxi sau phản ứng ứng thấy có 36g H2O đc sinh ra . Xác định thành phần phần trăm theo khối lượng của mỗi hỗn hợp hỗn hợp
CH4+2O2-to>CO2+2H2O
x----------------------------2x
2H2+O2-to>2H2O
y-------------------y
=>ta có :\(\left\{{}\begin{matrix}16x+2y=10\\2x+y=2\end{matrix}\right.\)
=>x=0,5 , y=1 mol
=>%m CH4=\(\dfrac{0,5.16}{10}100\)=80%
=>%m H2=20%
Đúng 2
Bình luận (0)