1. Tính phần trăm đồng vị 37Cl trong dung dịch HCl ? Ai có lòng giải bài này giúp em với ạ !

Những câu hỏi liên quan
Đề : Trong tự nhiên Chlorine có hai đồng vị bền: 37Cl chiếm 24,23% tổng số nguyên tử, còn lại là 35Cl. Tính số nguyên tử 35Cl có trong 50,24 gam dung dịch HClO4 30%Giúp mình bài này với ạ !
Đọc tiếp
Đề : Trong tự nhiên Chlorine có hai đồng vị bền: 37Cl chiếm 24,23% tổng số nguyên tử, còn lại là 35Cl. Tính số nguyên tử 35Cl có trong 50,24 gam dung dịch HClO4 30%
Giúp mình bài này với ạ !
Giải giúp em bài này với ạ!
Hòa tan 2g muối cacbonat của kim loại hóa trị II bằng dung dịch HCl 10% vừa đủ thu được 448cm3 chất khí ở đktc
a/ Tính mddHCl
b/ xác định CTHH của muối
c/ tính nồng độ phần trăm của chất tan trong dung dịch
gọi công thức muối là ACO3
n CO2=0,448:22,4=0,02mol
PTHH: ACO3+2HCl=>ACl2+CO2+H2O
0,02<--0,04<-0,02<-0,02->0,02
=> mHCl=0,04.36,5=1,46g
=> mddHCl=\(\frac{1,46}{10}.100=14,6g\)
ta có MACO3=2:0,02=100g/mol
=> M A=100-12-16.3=40
=> A là Ca
=> công thức muois là CACO3
ta có m CaCl2=0,02.111=2,22g
=> mddCaCl2=2+14,6-0,02.44-0,02.18=15,36g
=> C% CaCl2=2,22:15,36.100=14,45%
Đúng 0
Bình luận (3)
448 cm3 = 0,448 l
Gọi CTHH của muối cacbonat cần tìm là MCO3
MCO3 + 2HCl = MCl2 + CO2 + H2O
=> Khí thu được là CO2
Số mol CO2 là : 4,48 : 22,4 = 0,2 (mol)
Khối lượng CO2 là: 0,2 x 44 = 8,8 (g)
Theo PTHH: nHCl = 2 nCO2 = 0,2 x 2= 0,4 (mol)
Khối lượng HCl là: 0,4 x 36,5 = 14,6 (g)
Khối lượng dd HCl là : 14,6 : 10 x 100 = 146 (g)
Theo PTHH: nMCO3 = nCO2 = 0,2 (mol)
Khối lượng mol của MCO3 là: 20 : 0,2 = 100 (g)
Khối lượng mol của M: 100- 60 = 40 (g)
=> M là kim loại Ca
=> Muối cần tìm là CaCO3
Chất tan trong dung dịch là CaCl2
Theo PTHH: nCaCl2 = nCO2 = 0,2 (mol)
Khối lượng CaCl2 là : 111 x 0,2 = 22,2 (g)
Khối lượng dd mới là: 20 + 146 - 8,8 = 157,2 (g)
C% dd CaCl2 là: 22,2 :157,2 x 100 = 14,122%
Bạn ơi hình như bạn ghi sai đề, mk nghĩ muối cacbonat là 20g, không thể 2g được, bạn tham khảo nha
Đúng 0
Bình luận (4)
giải giúp em bài này vs ạ Tìm nguyên tử khối trung bình của đồng . Biết rằng trong thành phần phần trăm các đơn vị của đồng là 73% ⁶³Cu và 27% ⁶⁵Cu
Mn giúp e giải BT này với ạ. Hòa tan 6,5 g kim loại kẽm vào dung dịch HCl. Hãy tính: a) Thể tích khí Hiđro thoát ra(đktc)? b) Khối lượng muối tạo thành? c) Hòa tan lượng muối trên trong 172,8 g nước. Tính nồng độ phần trăm của dung dịch muối mới tạo thành? E cảm ơn mn nhiều ạ🥰🥰🥰.
a, \(n_{Zn}=\dfrac{6,5}{65}=0,1\left(mol\right)\)
PT: \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
Theo PT: \(n_{H_2}=n_{Zn}=0,1\left(mol\right)\Rightarrow V_{H_2}=0,1.22,4=2,24\left(l\right)\)
b, \(n_{ZnCl_2}=n_{Zn}=0,1\left(mol\right)\Rightarrow m_{ZnCl_2}=0,1.136=13,6\left(g\right)\)
c, m dd muối = 13,6 + 172,8 = 186,4 (g)
\(\Rightarrow C\%_{ZnCl_2}=\dfrac{13,6}{186,4}.100\%\approx7,3\%\)
Đúng 1
Bình luận (0)
\(pthh:Zn+2HCl--->ZnCl_2+H_2\uparrow\)
a. Ta có: \(n_{Zn}=\dfrac{6,5}{65}=0,1\left(mol\right)\)
Theo pt: \(n_{H_2}=n_{Zn}=0,1\left(mol\right)\)
\(\Rightarrow V_{H_2}=0,1.22,4=2,24\left(lít\right)\)
b. Theo pt: \(n_{ZnCl_2}=n_{Zn}=0,1\left(mol\right)\)
\(\Rightarrow m_{ZnCl_2}=0,1.136=13,6\left(g\right)\)
c. \(C_{\%_{ZnCl_2}}=\dfrac{m_{ZnCl_2}}{m_{dd_{ZnCl_2}}}.100\%=\dfrac{13,6}{13,6+172,8}.100\%=7,3\%\)
Đúng 0
Bình luận (0)
giúp em câu hỏi này với ạ, em vote cho luôn 10 điểm
câu hỏi ôn tập:khi hòa tan 16,8 g sắt bằng dung dịch HCl 21,90%
a) tính thể tích khí thu được
b) tính khối lượng axit cần dùng
c) tính nồng độ phần trăm của dung dịch sau phản ứng
\(n_{Fe}=\dfrac{16,8}{56}=0,3\left(mol\right)\)
PTHH :
\(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
0,3 0,6 0,3 0,3
\(a,V_{H_2}=0,3.22,4=6,72\left(l\right)\)
\(b,m_{HCl}=0,6.36,5=21,9\left(g\right)\)
\(m_{ddHCl}=\dfrac{21,9.100}{21,90}=100\left(g\right)\)
\(c,m_{FeCl_2}=127.0,3=38,1\left(g\right)\)
\(m_{ddFecl_2}=\left(16,8+100\right)-0,3.2=116,2\left(g\right)\)
\(C\%_{ddFeCl_2}=\dfrac{38,1}{116,2}.100\%\approx37,79\%\)
Đúng 3
Bình luận (1)
Ai giúp em bài này với được không ạ em đang cần gấp, em cảm ơn nhiều lắm ạ Cho m gam hỗ hợp X gồm Mg và FeCO3 vào dung dịch H2SO4 loãng thu được 6,72 lít hỗn hợp khí A bay ra (đktc). Biết A có tỉ khối hơi so với hidro là 15a. Tính phần trăm khối lượng mỗi chất trong hỗn hợp Xb. Nếu cho hỗn hợp X trên tác dụng với axit H2SO4 đ, nóng, dư thì thu đượ bao nhiêu lít hỗn hợp khí SO2 và CO2 (đktc)?
Đọc tiếp
Ai giúp em bài này với được không ạ em đang cần gấp, em cảm ơn nhiều lắm ạ ![]()
Cho m gam hỗ hợp X gồm Mg và FeCO3 vào dung dịch H2SO4 loãng thu được 6,72 lít hỗn hợp khí A bay ra (đktc). Biết A có tỉ khối hơi so với hidro là 15
a. Tính phần trăm khối lượng mỗi chất trong hỗn hợp X
b. Nếu cho hỗn hợp X trên tác dụng với axit H2SO4 đ, nóng, dư thì thu đượ bao nhiêu lít hỗn hợp khí SO2 và CO2 (đktc)?
\(a) n_{CO_2} = a(mol) ; n_{H_2} = b(mol)\\ n_A = \dfrac{6,72}{22,4} = 0,3(mol)\)
Ta có :
a + b = 0,3
44a + 2b = 0,3.2.15
Suy ra a = 0,2 ; b = 0,1
\(Mg + H_2SO_4 \to MgSO_4 + H_2\\ FeCO_3 + H_2SO_4 \to FeSO_4 + CO_2 + H_2O\\ \)
n Mg = n H2 = 0,1(mol)
n FeCO3 = n CO2 = 0,2(mol)
\(\%m_{Mg} = \dfrac{0,1.24}{0,1.24 + 0,2.116}.100\% = 9,375\%\\ \%m_{FeCO_3} = 100\%-9,375\% = 90,625\%\)
b)
Bảo toàn nguyên tố C : n CO2 = n FeCO3 = 0,2(mol)
Bảo toàn e : 2n SO2 = 2n Mg + n FeCO3
=> n SO2 = (0,1.2 + 0,2)/2 = 0,2(mol)
=> V khí = (0,2 + 0,2).22,4 = 8,96 lít
Đúng 3
Bình luận (1)
Trong tự nhiên đồng vị 37Cl chiếm 24,23% số nguyên tử clo. Nguyên tử khối trung bình của clo bằng 35,5. Thành phần phần trăm về khối lượng của 37Cl có trong HClO4 là (với 1H, 16O): A. 9,82%. B. 8,65%. C. 8,92%. D. 8,56%.
Đọc tiếp
Trong tự nhiên đồng vị 37Cl chiếm 24,23% số nguyên tử clo. Nguyên tử khối trung bình của clo bằng 35,5. Thành phần phần trăm về khối lượng của 37Cl có trong HClO4 là (với 1H, 16O):
A. 9,82%.
B. 8,65%.
C. 8,92%.
D. 8,56%.
Đáp án : C
Xét 1 mol HClO4 có 1 mol Cl
=> có 0,2423 mol 37Cl
=> %mCl(37) = 8,92%
Đúng 0
Bình luận (0)
Trong tự nhiên đồng vị 37Cl chiếm 24,23% số nguyên tử clo. Nguyên tử khối trung bình của clo bằng 35,485. Thành phần phần trăm về khối lượng của 37Cl có trong HClO4 là (với 1H, 16O) A. 9,82% B. 8,65%. C. 8,56%. D. 8,92%.
Đọc tiếp
Trong tự nhiên đồng vị 37Cl chiếm 24,23% số nguyên tử clo. Nguyên tử khối trung bình của clo bằng 35,485. Thành phần phần trăm về khối lượng của 37Cl có trong HClO4 là (với 1H, 16O)
A. 9,82%
B. 8,65%.
C. 8,56%.
D. 8,92%.
Đáp án D
• Phần trăm khối lượng của 37Cl có trong HClO4 là
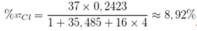
Đúng 0
Bình luận (0)
Mn giúp em bài này với : 20,8g hỗn hợp Cu, CuO bằng 1 lượng vừa đủ 200ml dung dịch HCl 1M.
a, viết PTHH.
b, tính thành phần % theo khối lượng mỗi chất trong hh
\(a,PTHH:CuO+2HCl\to CuCl_2+H_2O\\ b,n_{HCl}=0,2.1=0,2(mol)\\ \Rightarrow n_{CuO}=0,2(mol)\Rightarrow m_{CuO}=0,2.80=16(g)\\ \Rightarrow \%_{CuO}=\dfrac{16}{20,8.}100\%=76,92\%\\ \Rightarrow \%_{Cu}=100\%-76,92\%=23,08\%\)
Đúng 1
Bình luận (0)






















