Hòa tan 7,8 gam Kali vào nước thu được dung dịch A và khí B. Dẫn khí B qua 16 gam CuO đun nóng. Phản ứng xảy ra hoàn toàn.
a. Tính thể tích khí B ở đktc và khối lượng khí A.
b. Tính khối lượng kim loại Cu thu được.
a, miếng kim loại nhôm vào 500 ml dung dịch HCl 2M. Tính thể tích khí H2 thoát ra (đktc) và khối lượng muối tạo thành b, nếu dẫn toàn bộ lượng khí trên qua CuO đun nóng thì khối lượng CuO phản ứng là bao nhiêu gam?
\(n_{HCl}=0.5\cdot2=1\left(mol\right)\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(..........1.........\dfrac{1}{3}.......0.5\)
\(V_{H_2}=0.5\cdot22.4=11.2\left(l\right)\)
\(m_{AlCl_3}=\dfrac{1}{3}\cdot133.5=44.5\left(g\right)\)
\(CuO+H_2\underrightarrow{^{t^0}}Cu+H_2O\)
\(0.5.....0.5\)
\(m_{CuO}=0.5\cdot80=40\left(g\right)\)
Hòa tan hoàn toàn 15,6 gam kim loại kali vào nước thu được dung dịch kalihidroxit và khí hidro a. Tính thể tích khí H2 sinh ra (ở đktc). b. Tính khối lượng của dung dịch thu được. c. Nêu và giải thích hiện tượng khi nhúng quì tím vào dung dịch thu được ở trên. (Biết K=39, H=1, O=16, Na = 23, Cl = 35,5)
Số mol của 15,6 K là:
nK = \(\dfrac{m}{M}\) = \(\dfrac{15,6}{39}\) = 0,4 mol
PTHH: 2K + 2H2O \(\rightarrow\) 2KOH + H2
Tỉ lệ : 2 : 2 : 2 : 1
Mol: 0,4 \(\rightarrow\) 0,4 \(\rightarrow\) 0,2
a. Thể tích khí H2 ở đktc là:
VH2 = n . 22,4 = 0,2 . 22,4 = 4,48 l
b. Khối lượng dung dịch thu được:
mKOH = n . M = 0,4 . 56 = 22,4 g
c. Vì là một bazơ nên dung dịch KOH làm quỳ tím đổi màu thành xanh.
\(n_K=\dfrac{m}{M}=\dfrac{15,6}{39}=0,4\left(mol\right)\)
\(PTHH:2K+2H_2O\rightarrow2KOH+H_2\uparrow\)
\(2:2:2:1\) ( tỉ lệ mol )
\(0,4:0,4:0,4:0,2\left(mol\right)\)
\(a,V_{H_2}=n.22,4=0,2.22,4=4,48\left(l\right)\)
\(b,m_{KOH}=n.M=0,4.\left(39+16+1\right)=0,4.56=22,4\left(g\right)\)
\(c,\) Hiện tượng : Kali tan dần trong nước, tỏa ra khí \(H_2\)
hòa tan hết 3,9(g) K vào nước thu được dung dịch X và khí Y
a) tính khối lượng X và tính thể tích Y (đktc)
b) dẫn toàn bộ Y qua ống nghiệm đựng 20(g) CuO nung nóng. kết thúc phản ứng thu được chất rắn Z. tính khối lượng Z (biết phản ứng xảy ra hoàn toàn)
\(n_K=\dfrac{3.9}{39}=0.1\left(mol\right)\)
\(K+H_2O\rightarrow KOH+\dfrac{1}{2}H_2\)
\(0.1..................0.1......0.05\)
\(m_{KOH}=0.1\cdot56=5.6\left(g\right)\)
\(V_{H_2}=0.05\cdot22.4=1.12\left(l\right)\)
\(n_{CuO}=\dfrac{20}{80}=0.25\left(mol\right)\)
\(CuO+H_2\underrightarrow{^{^{t^0}}}Cu+H_2O\)
\(1.........1\)
\(0.25.......0.05\)
\(LTL:\dfrac{0.25}{1}>\dfrac{0.05}{1}\Rightarrow CuOdư\)
\(m_Z=m_{Cu}+m_{CuO\left(dư\right)}=0.05\cdot64+\left(0.25-0.05\right)\cdot80=19.2\left(g\right)\)
Cho 4,8 gam magie tan hoàn toàn vào dung dịch axit sunfuric loãng
a) VIết PTHH của phản ứng
b) Tính khối lượng axit sunfuric cần dùng
c) Tính thể tích khí H2 thu được (đktc)
d) Dẫn toàn bộ lượng khí H2 sinh ra cho đi qua sắt (II) oxit đun nóng. Tính khối lượng Fe sinh ra sau phản ứng?
\(n_{Mg}=\dfrac{4,8}{24}=0,2\left(mol\right)\\ pthh:Mg+2HCl\rightarrow MgCl_2+H_2\)
0,2 0,4 0,2
\(\Rightarrow m_{HCl}=0,4.36,5=14,6\left(g\right)\\ V_{H_2}=0,2.22,4=4,48\left(l\right)\\ pthh:FeO+H_2\underrightarrow{t^o}Fe+H_2O\)
0,2 0,2 0,2
\(m_{Fe}=0,2.56=11,2\left(g\right)\)
Hòa tan hoàn toàn 27,4g gam kim loại bari vào nước dư thu được dung dịch bari hidroxit và giải phóng khí hidro. a)Viết PTHH của phản ứng. b)Tính khối lượng bari hidroxit tạo thành. c)Tính thể tích khí hidro sinh ra ở đktc. Biết rằng khi thu khí bị thất thoát 20%. Giải chi tiết nha mọi người
Ba + 2H2O -- > Ba(OH)2 + H2
nBa = 27,4 / 137 = 0,2 (mol)
mBa(OH)2 = 0,2 . 171 = 34,2 (g)
VH2 = 0,2.22,4 = 4,48 (l)
VH2(thực tế ) = 4,48 .80%=3,584 (l )
\(n_{Ba}=\dfrac{27,4}{137}=0,2\left(mol\right)\\
pthh:Ba+2H_2O\rightarrow Ba\left(OH\right)_2+H_2\)
0,2 0,2 0,2
\(m_{Ba\left(OH\right)_2}=0,2.154=30,8\left(g\right)\\
V_{H_2}=\left(0,2.22,4\right).80\%=3,584l\)
Câu 3. Hòa tan 5,6g sắt vào dd HCl thu được FeCl2 và H2 a. Tính khối lượng FeCl2 thu được sau phản ứng. b. Tính thể tích khí H2 thoát ra (đktc). c. Tính khối lượng sắt thu được khi dẫn toàn bộ lượng khí thoát ra ở trên đi qua ống đựng 16 gam sắt (III) oxit nung nóng
chỉ cần giải câu c thôi ạ!! giải chi tiết hộ ạ!!
mn giúp mik với ạ mai mik thi rồi!! cảm ơn ạ!!Câu 3:
c, Từ phần trên, có nH2 = nFe = 0,1 (mol)
\(n_{Fe_2O_3}=\dfrac{16}{160}=0,1\left(mol\right)\)
\(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
Xét tỉ lệ: \(\dfrac{0,1}{1}>\dfrac{0,1}{3}\), ta được Fe2O3 dư.
Theo PT: \(n_{Fe}=\dfrac{2}{3}n_{H_2}=\dfrac{1}{15}\left(mol\right)\Rightarrow m_{Fe}=\dfrac{1}{15}.56=\dfrac{56}{15}\left(g\right)\)
a) \(n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\)
PTHH: `Fe + 2HCl -> FeCl_2 + H_2`
0,1-->0,2----->0,1------>0,1
`=> m_{FeCl_2} = 0,1.127 = 12,7 (g)`
b) `V_{H_2} = 0,1.22,4 = 2,24 (l)`
c) `n_{Fe_2O_3} = (16)/(160) = 0,1 (mol)`
PTHH: \(Fe_2O_3+3H_2\xrightarrow[]{t^o}2Fe+3H_2O\)
Xét tỉ lệ: \(0,1>\dfrac{0,1}{3}\Rightarrow\) Fe2O3
Theo PT: \(n_{Fe}=\dfrac{2}{3}.n_{H_2}=\dfrac{1}{15}\left(mol\right)\)
\(\Rightarrow m_{Fe}=\dfrac{1}{15}.56=\dfrac{56}{15}\left(g\right)\)
PTHH: \(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(Fe_2O_3+3H_2\rightarrow2Fe+3H_2O\)
\(n_{Fe}=\dfrac{m}{M}=\dfrac{5,6}{56}=0,1\left(mol\right)\)
Theo PTHH: \(n_{Fe}=n_{H_2}=n_{FeCl_2}=0,1\left(mol\right)\)
\(m_{FeCl_2}=n.M=0,1.127=12,7\left(g\right)\)
\(V_{H_2\left(đktc\right)}=n.22,4=0,1.22,4=2,24\left(l\right)\)
\(n_{Fe_2O_3}=\dfrac{m}{M}=\dfrac{16}{160}=0,1\left(mol\right)\)
Ta có: \(\dfrac{0,1}{1}>\dfrac{0,1}{3}\)
=> sau pư, H2 hết và Fe2O3 dư
=> theo \(n_{H_2}\)
Theo PTHH: \(n_{Fe}=\dfrac{2}{3}n_{H_2}=\dfrac{2}{3}.0,1=\dfrac{1}{15}\left(mol\right)\)
=> \(m_{Fe}=n.M=\dfrac{1}{15}.56=\dfrac{56}{15}\left(g\right)\)
hòa tan hoàn toàn 4,6g kim loại Na vào nước. a) Viết phương trình hóa học xảy ra. b)tính thể tích khi thu được ở điều kiện tiêu chuẩn. c)Dẫn toàn bộ lượng khí thu được ở trên qua ống sứ đựng 16g CuO đun nóng. Sau khi phản ứng xảy ra hoàn toàn thu được m gam chất rắn. Tính m
giúp mình giải quyết nhanh vs ạ
a) Pt: 2Na + 2H2O \(\rightarrow\) 2NaOH + H2
b) nNa = \(\dfrac{4,6}{23}=0,2mol\)
Theo pt: \(n_{H_2}=\dfrac{1}{2}n_{Na}=0,1mol\)
=> \(V_{H_2}=0,1.22,4=2,24l\)
c) Pt: \(CuO+H_2\xrightarrow[]{t^o}Cu+H_2O\)
nCuO = 16 : 80 = 0,2mol
Có nCuO : nH2 = \(\dfrac{0,2}{1}:\dfrac{0,1}{1}=2:1\)
=> CuO dư
Theo pt: nCu = nH2 = 0,1mol
=> mCu = 0,1.64 = 6,4g
a)
2Na + 2H2O ---> 2NaOH + H2.
b) Ta có:
nNa = 4,6/23 = 0,2 (mol)
Từ pt => nH2 = 0,2/2 = 0,1 (mol)
=> VH2 = 0,1.22,4 = 2,24 (lít)
c) CuO + H2 --to--> Cu + H2O
Ta có:
nCuO = 16/(64 + 16) = 0,2 (mol)
Lập tỉ lệ:
nCuO(tt)/nCuO(pt) = 0,2/1 = 0,2
nH2(tt)/nH2(pt) = 0,1/1 = 0,1
Vì 0,2 > 0,1 nên CuO dư
=> tính theo số mol của H2 => nCuO = 0,1 (mol)
Khối lượng chất rắn cần tìm là:
mCu = 0,1.64 = 6,4 (g)
Chia 7,72 gam hỗn hợp X gồm Fe và hai oxit kim loại MO, R2O3 thành hai phần bằng nhau. Dùng một lượng vừa đủ dung dịch H2SO4 loãng hòa tan hoàn toàn phần 1, thu được khí B và dung dịch D chứa 9,7 gam muối. Dẫn toàn bộ lượng khí B sinh ra qua ống đựng 1,6 gam CuO nung nóng, đến khi thu được 1,408 gam chất rắn thì đã có 80% lượng khí B tham gia phản ứng. Mặt khác, dẫn dòng khí CO dư qua phần 2 nugn nóng, sau khi phản ứng xảy ra hoàn toàn thu được 3,46 gam chất rắn. Biết rằng nguyên tử khối của M gấp 2,37 lần nguyên tử khối của R. Cho các phản ứng được thực hiện trong điều kiện không có không khí. Xác định 2 kim loại M, R và tính % khối lượng các chất trong hỗn hợp X.
m rắn giảm = mO (oxit) => nO (oxit) = (1,6 – 1,408) : 16 = 0,012mol
Dễ thấy n = nO (oxit) = 0,012mol
=> nH2 ban đầu = 0,012 : 80% = 0,015
=> nFe = nH2= 0,015 → x = 0,015
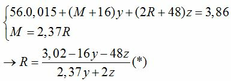
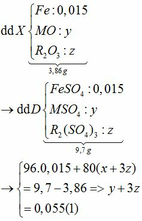
Ta có: CO + O(Oxit) → CO2
Vì: m(Rắn giảm) = mO(Oxit) → nO(Oxit) = (3,86 – 3,46) : 16 = 0,025
TH1: cả 2 oxit đều bị khử bởi CO
→ nO(Oxit) = y + 3z = 0,025 kết hợp với (1) loại
TH2: chỉ có MO bị khử bởi CO
→ nO(Oxit) = nMO = 0,025 → y = 0,025 kết hợp với (1) => z = 0,01
Kết hợp với (*) => M = 64 (Cu)
TH3: chỉ có R2O3 bị khử bởi CO
→ nO(Oxit) = 3.nR2O3 → z = 0,025/3 kết hợp với (1) => y = 0,03
Kết hợp với (*) y => M lẻ => loại
Vậy %m các chất trong X là: 21,76%; 51,81%; 26,43%
Câu 1: Cho 3,5 gam Zn tác dụng với dung dịch HCl dư. Dẫn toàn bộ lượng khí thu được qua CuO đun nóng
a. Viết phương trình phản ứng
b. Tính thể tích khí (đktc) thu được sau phản ứng
c. Tính khối lượng đồng thu được sau phản ứng
Câu 2: Cho 2,7 gam kim loại nhôn tác dụng hết với 200g dung dịch HCl 7,3%
a. Tính thể tích khí H2 thu được (ở đktc)
b. Tính nồng độ % các chất trong dung dịch sau phản ứng.
Câu 1 :
a) PTHH :
\(Zn+2HCl\rightarrow ZnCl_2+H_2\uparrow\) (1)
\(H_2+CuO\underrightarrow{t^o}Cu+H_2O\)(2)
b) Ta có : \(n_{Zn}=\frac{3,5}{65}\approx0,054\left(mol\right)\)
Theo phương trình hóa học (1) :
\(n_{H_2}=n_{Zn}\approx0,054\left(mol\right)\)
\(\Rightarrow V_{H_2}\approx0,054\cdot22,4=1,2096\left(l\right)\)
c) Theo phương trình hóa học (2), ta có:
\(n_{Cu}=n_{H_2}\approx0,054\left(mol\right)\)
\(\Rightarrow m_{Cu}\approx0,054\cdot64=3,456\left(g\right)\)
Bài 2:
a) Ta có : \(n_{Al}=\frac{2,7}{27}=0,1\left(mol\right)\); \(n_{HCl}=\frac{200\cdot7,3}{100\cdot36,5}=0,4\left(mol\right)\)
PTHH: \(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
Theo phương trình hóa học : \(n_{H_2}=\frac{3}{2}n_{Al}=\frac{3}{2}.0,1=0,15\left(mol\right)\)
\(\Rightarrow V_{H_2}=0,15\cdot22,4=3,36\left(l\right)\)
b) Theo phương trình hóa học , ta có : \(n_{AlCl_3}=n_{Al}=0,1\left(mol\right)\)
\(\Rightarrow m_{AlCl_3}=0,1\cdot133,5=13,35\left(g\right)\)
Lại có: \(m_{H_2}=0,15\cdot2=0,3\left(g\right)\)
Áp dụng định luật bảo toàn khối lượng, ta có:
\(m_{Al}+m_{dd_{HCl}}=m_{dd_{AlCl_3}}+m_{H_2}\)
\(\Leftrightarrow2,7+200=m_{dd_{AlCl_3}}+0,3\)
\(\Leftrightarrow m_{dd_{AlCl_3}}=202,4\left(g\right)\)
Vậy \(C\%_{dd_{AlCl_3}}=\frac{13,35}{202,4}\cdot100\%\approx6,6\%\)
BÀI TẬP 5: Hòa tan hoàn toàn 8g gam kim loại canxi vào nước dư thu được dung dịch canxi hidroxit và giải phóng khí hidro. a)Viết PTHH của phản ứng. b)Tính khối lượng canxi hidroxit tạo thành. c)Tính thể tích khí hidro sinh ra ở đktc. Biết rằng khi thu khí bị thất thoát 20%.
Ca + 2H2O --> Ca(OH)2 + H2
0,2 0,4 0,2 0,2
nCa=8/40=0,2(mol)
b/
mCa(OH)2=0,2.74=14,8(g)
VH2=0,2.22,4.80%=3,584(l)