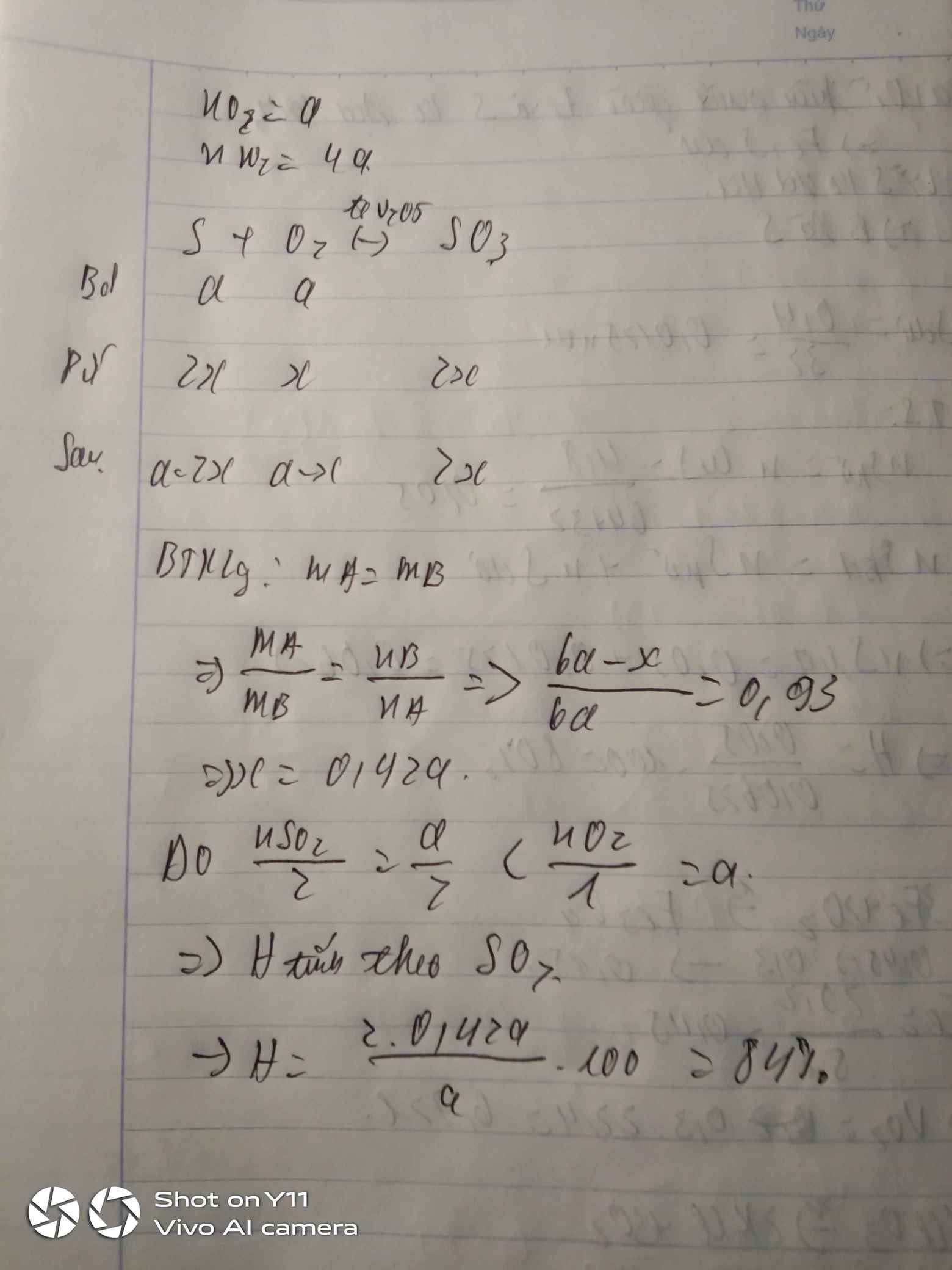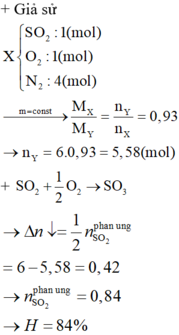Nung nóng hỗn hợp khí A gồm x mol SO2 và 5x mol không khí với xúc tác là V2O5 thu được hỗ hợp khí B. Biết tỉ khối của A so với B là 0,925. Tính hiệu suất phản ứng của SO2 với O2. Giả thiết không khí chứa 20% thể tích là O2, phần còn lại là N2

Những câu hỏi liên quan
Hỗn hợp khí A gồm a mol SO2 và 5a mol không khí. Nung nóng hỗn hợp A với V2O5 xúc tác thu được hỗn hợp khí B. Biết rằng tỉ khối hơi của A so với B bằng 0,93. Hãy tính hiệu suất phản ứng giữa SO2 và O2. Cho không khí có chưa 80% N2 và 20% O2 theo thể tích.
giúp em nhanh với e tick nhanh cho ạ , em cảm ơn ạ
Hỗn hợp A ban đầu có SO2 : a mol, N2: 4a mol và O2: a mol.
Phản ứng:
2SO2 + O2< --> 2SO3 (XT: V2O5, t0) (1)
Gọi số mol SO2 phản ứng là x.
Theo (1): Số mol giảm = số mol O2 phản ứng = 0,5x mol
=> nB = 6a – 0,5x mol
Theo định luật bảo toàn khối lượng: mA = mB = m
\(d_{A/B}=\dfrac{m}{6a}:\dfrac{m}{6a-0,5x}=\dfrac{6a-0,5x}{6a}=0,93\)
\(\Rightarrow\dfrac{x}{a}=0,84\)
\(VậyH\%=84\%\)
Đúng 2
Bình luận (2)
Hỗn hợp A gồm SO2 và không khí có tỉ lệ số mol là 1: 5. Nung nóng hỗn hợp A với xúc tác V2O5 thì thu được hỗn hợp khí B. Tỉ khối của A so với B là 0,93. Hiệu suất của phản ứng trên là (cho biết không khí có 20% O2 và 80% N2): A. 84%. B. 42%. C. 50%. D. 25%.
Đọc tiếp
Hỗn hợp A gồm SO2 và không khí có tỉ lệ số mol là 1: 5. Nung nóng hỗn hợp A với xúc tác V2O5 thì thu được hỗn hợp khí B. Tỉ khối của A so với B là 0,93. Hiệu suất của phản ứng trên là (cho biết không khí có 20% O2 và 80% N2):
A. 84%.
B. 42%.
C. 50%.
D. 25%.
Hỗn hợp khí A gồm a mol SO2 và 5a mol không khí. Nung nóng hh A với O2 xúc tác V2O5 thu được hh khí B. Biết dA/B = 0,93. TÍnh Hiệu suất PỨ giả thiết ko khí có 80%V là N2; 20% là O2.
Hỗn hợp A ban đầu có SO2: a mol, N2: 4a mol và O2: a mol.
Phản ứng:
2SO2 + O2 <=> 2SO3 (XT: V2O5, t\(^o\)) (1)
Gọi số mol SO2 phản ứng là x.
Theo (1): Số mol giảm = số mol O2 phản ứng = 0,5x mol
=> nB = 6a – 0,5x mol
Theo định luật bảo toàn khối lượng: mA = mB = m
dA/B = \(\dfrac{m}{6a}:\) \(\dfrac{m}{6a-0,5x}\) \(=\dfrac{6a-0,5x}{6a}\) = 0,93
=> \(\dfrac{x}{a}\) = 0,84
Vậy H% = 84%.
Đúng 2
Bình luận (0)
Hỗn hợp khí A gồm a mol SO2 và 5a mol không khí. Nung nóng hh A với O2 xúc tác V2O5 thu được hh khí B. Biết dA/B = 0,93. TÍnh Hiệu suất PỨ giả thiết ko khí có 80%V là N2; 20% là O2. Giải thích giúp mình tại sao bài này là Số mol.của B = 6a-x/2
Hỗn hợp khí A gồm SO2 và không khí có tỉ lệ thể tích là 1 : 5. Nung hỗn hợp A với xúc tác V2O5 trong một bình kín có dung tích không đổi thu được hỗn hợp khí B. Tỉ khối của A so với B là 0,93. Không khí có 20% thể tích là O2 và 80% thể tích là N2. Tính hiệu suất của phản ứng oxihoa SO2 :
A. 75% B. 86% C. 84% D. 80%
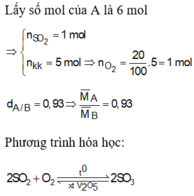
gia su co 1 mol SO2 ,suy ra co 5 mol khong khi tuc la co 1 mol O2 va 4 mol N2
ti khoi cua A la d(A)= ( 1*64+1*32+4*28)/(1+5)=208/6
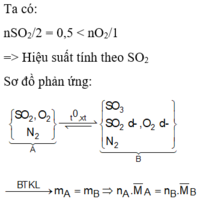
khi nung hon hop A voi V2O5 xay ra phan ung
2SO2 + O2 ----> 2SO3 (1)
2a ---->a -------->2a
dat so mol oxi phan ung la a suy ra so mol SO2 bang so mol SO3 = 2a
sau phan ung (1) so mol cua hon hop giam di a mol -> so mol cua hon hop B la (6-a) mol, khoi luong cua B = khoi luong cua A = 208 gam -> d(B) = 208/(6-a)
d(A)/d(B) =(6-a)/6 = 0.93 -> a= 0.42 -> so mol SO2 = 2a = 0.84 mol
trong hon hop A do oxi du nen hieu suat phan ung tinh theo SO2
H= 0.84/1 = 0.84 = 84% ->dap an C
Đúng 0
Bình luận (0)
Hỗn hợp khí X gồm SO2 và không khí có tỉ lệ thể tích tương ứng là 1:5. Đun nóng hỗn hợp X với xúc tác V2O5 trong một bình kín có dung tích không đổi thu được hỗn hợp khí Y. Tỉ khối hơi của X so với Y là 0,93. Không khí có 20% thể tích là O2 và 80% thể tích là N2. Hiệu suất của phản ứng oxi hóa SO2 là A. 84%. B. 75%. C. 80%. D. 42%.
Đọc tiếp
Hỗn hợp khí X gồm SO2 và không khí có tỉ lệ thể tích tương ứng là 1:5. Đun nóng hỗn hợp X với xúc tác V2O5 trong một bình kín có dung tích không đổi thu được hỗn hợp khí Y. Tỉ khối hơi của X so với Y là 0,93. Không khí có 20% thể tích là O2 và 80% thể tích là N2. Hiệu suất của phản ứng oxi hóa SO2 là
A. 84%.
B. 75%.
C. 80%.
D. 42%.
Một hỗn hợp khí X gồm SO2 và O2, có có tỉ khối so với H2 là 28. Nung nóng hỗn hợp có xúc tác (V2O5, ở 450oC) một thời gian hỗn hợp khí Y. Tính % thể tích các khí trong Y biết hiệu suất phản ứng là 80%.
13,44 lít hỗn hợp khí X (gồm SO2 và O2 ở đktc) có tỉ khối so với H2 là 24. Đun nóng X với V2O5 một thời gian thu được 0,5 mol hỗn hợp Y. Tính % thể tích hỗn hợp khí X và hiệu suất phản ứng.
Nung nóng 8,96 lít hỗn hợp khí X gồm SO2 và O2 (tỷ lệ mol 3:1) với xúc tác V2O5, sau một thời gian thu được 7,616 lít hỗn hợp khí Y. Tính hiệu suất phản ứng, biết rằng các thể tích khí đều được đo ở đktc, phản ứng hoá học đã xảy ra như sau: 2SO2 + O2 2SO3