Đốt cháy hoàn toàn 21,0 gam dây sắt trong không khí thu được 29,4 gam hỗn hợp các oxit Fe2O3 và Fe3O4. Khối lượng Fe2O3 tạo thành là:
A. 12,0 g
B. 13,5g
C. 16,5g
D. 18,0g
*ghi cả đáp án và lời giải giúp mình*
Để khử hoàn toàn 62,4 gam hỗn hợp Fe2O3 và Fe3O4 cần vừa đủ 2,2 gam khí hiđro.
a) Tính khối lượng từng oxit trong hỗn hợp đầu.
b) Tính khối lượng Fe tạo thành sau phản ứng.
a)
Gọi $n_{Fe_2O_3} = a ; n_{Fe_3O_4} = b$
Ta có : $160a + 232b = 62,4(1)$
$Fe_2O_3 + 3H_2 \xrightarrow{t^o} 2Fe + 3H_2O$
$Fe_3O_4 + 4H_2 \xrightarrow{t^o} 3Fe + 4H_2O$
$n_{H_2} = 3a + 4b = 2,2 :2 = 1,1(2)$
Từ (1)(2) suy ra a = 0,1 ; b = 0,2
$m_{Fe_2O_3} = 0,1.160 = 16(gam)$
$m_{Fe_3O_4} = 0,2.232 = 46,4(gam)$
b)
$n_{Fe} = 2a + 3b = 0,8(mol)$
$m_{Fe} = 0,8.56 = 44,8(gam)$
Để khử hoàn toàn 35,2 gam hỗn hợp gồm Fe, FeO, Fe3O4, Fe2O3 cần vừa đủ 7,28 lít khí CO (đktc). Khối lượng sắt thu được là:Để khử hoàn toàn 35,2 gam hỗn hợp gồm Fe, FeO, Fe3O4, Fe2O3 cần vừa đủ 7,28 lít khí CO (đktc). Khối lượng sắt thu được là:
A. 31 gam.
B. 34 gam.
C. 32 gam.
D. 30 gam.
Chọn đáp án D
Cách 1:
![]()
⇒ Chọn D
Cách 2: Bảo toàn khối lượng khi đã biết nCO = nCO2 = 0,325 theo bảo toàn nguyên tố. Ta có sơ đồ
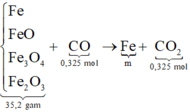
![]()
⇒ Chọn D
Đốt cháy hoàn toàn 46,4 gam sắt trong không khí thì thu được sắt lll oxit là Fe2O3. a/tính khối lượng sắt lll oxit và tính khối lượng oxi cần dùng theo hai cách. b/Tính thể tích không khí cần dùng (ở đktc)? Biết Vo2 = 1/5 Vkk

nFe = 46,4/56 = 29/35 (mol)
PTHH: 4Fe + 3O2 -> (t°) 2Fe2O3
Mol: 29/35 ---> 87/140 ---> 29/70
mFe2O3 = 29/70 . 160 = 464/7 (g)
Vkk = 87/140 . 5 . 22,4 = 69,6 (l)
Để khử hoàn toàn m gam hỗn hợp Fe2O3 và Fe3O4 cần vừa đủ 2,2 gam khí hiđro. Biết trong hỗn hợp, % khối lượng oxi là 28,205%.
a) Viết các PTHH xảy ra.
b) Tìm m (3 cách).
c) Tính khối lượng từng oxit trong hỗn hợp đầu.
d) Tính khối lượng Fe tạo thành sau phản ứng.
bài 1: Để khử hoàn toàn m gam hỗn hợp Fe2O3 và Fe3O4 cần vừa đủ 2,2 gam khí hiđro. Biết trong hỗn hợp, % khối lượng oxi là 28,205%.
a/ Viết các PTHH.
b/ Tìm m (2 cách).
c/ Tính khối lượng từng oxit trong hỗn hợp đầu.
d/ Tính khối lượng Fe tạo thành sau phản ứng.
______
bài 2: Để khử hoàn toàn 62,4 gam hỗn hợp Fe2O3 và Fe3O4 cần vừa đủ 2,2 gam khí hiđro.
a) Tính khối lượng từng oxit trong hỗn hợp đầu.
b) Tính khối lượng Fe tạo thành sau phản ứng.
Bài 1 :
a)
$Fe_2O_3 + 3H_2 \xrightarrow{t^o} 2F e+ 3H_2O$
$Fe_3O_4 + 4H_2 \xrightarrow{t^o} 3Fe + 4H_2O$
b)
Cách 1 : Gọi $n_{Fe_2O_3} = a ; n_{Fe_3O_4} = b$
Ta có :
$\dfrac{16(3a + 4b)}{160a + 232b}.100\% = 28,205\%$
$n_{H_2} = 3a + 4b = 2,2 : 2 = 1,1$
Suy ra: $a = 0,1 ; b = 0,2$
Suy ra: $m =0,1.160 + 0,2.232 = 62,4(gam)$
Cách 2 :
$n_{O(oxit)} = n_{H_2} = 1,1(mol)$
$m_O = 1,1.16 = 17,6(gam)$
$\Rightarrow m = 17,6 : 28,205\% = 62,4(gam)$
c)
$m_{Fe_2O_3} = 0,1.160 = 16(gam)$
$m_{Fe_3O_4} = 0,2.232 = 46,4(gam)$
d)
$n_{Fe} = 2a + 3b = 0,8(mol)$
$m_{Fe} = 0,8.56 = 44,8(gam)$
Để m (g) bột sắt ngoài không khí một thời gian thu được 12 gam hỗn hợp các chất rắn FeO, Fe3O4, Fe2O3, Fe. Hòa tan hoàn toàn hỗn hợp đó bằng dung dịch HNO3 loãng thu được 2,24 lít khí NO duy nhất (đktc). a) Tính m . b) tính m muối tạo thành
Chỉ đáp án thôi ạ em đang cần gấp
Quy đổi hỗn hợp thành : Fe ( x mol ) , O ( y mol )
\(m=56x+16y=12\left(g\right)\left(1\right)\)
Bảo toàn e :
\(3x=0.1\cdot3+2y\left(2\right)\)
\(\left(1\right),\left(2\right):x=0.18,y=0.12\)
\(m_{Fe}=0.18\cdot56=10.08\cdot\left(g\right)\)
\(m_{Fe\left(NO_3\right)_3}=0.18\cdot242=43.56\left(g\right)\)
a)
Coi hỗn hợp gồm Fe(x mol) và O(y mol)
Ta có :
$56x + 16y = 12$
Bảo toàn e : $3x - 2y = 0,1.3$
Suy ra x = 0,18 ; y = 0,12
$m = 0,18.56 = 10,08(gam)$
b)
$n_{Fe(NO_3)_3} = 0,18(mol)$
$m_{Fe(NO_3)_3} = 0,18.242 = 43,56(gam)$
bài 1: Để khử hoàn toàn 62,4 gam hỗn hợp Fe2O3 và Fe3O4 cần vừa đủ lượng khí hiđro chứa 13,2.6.1023 nguyên tử hiđro.
a/ Tính khối lượng từng oxit trong hỗn hợp đầu.
b/ Tính khối lượng Fe tạo thành sau phản ứng.
bài 2: Cho 7,1 gam hỗn hợp A gồm kẽm và sắt (III) oxit tác dụng hết với axit clohiđric thu được 1,344 lít khí ở đktc và dung dịch chứa ZnCl2, FeCl3.
a) Tính khối lượng axit tham gia phản ứng.
b) Khí sinh ra phản ứng vừa đủ với 3,92 gam hỗn hợp B gồm CuO và Fe3O4 nung nóng. Xác định khối lượng các chất có trong chất rắn sau phản ứng (gồm Cu và Fe).
bài 3: Trên 2 đĩa cân để hai cốc đựng dung dịch HCl và H2SO4 sao cho cân ở vị trí thăng bằng:
- Cho 5,4 gam Al tan hết trong cốc đựng dung dịch HCl.
- Cho a gam Fe tan hết trong cốc đựng dung dịch H2SO4.
Sau thí nghiệm, cân ở vị trí thăng bằng. Tính a.
Câu 1 : a) \(n_{H_2}=\dfrac{13,2.10^{23}}{6.10^{23}}=2,2\left(mol\right)\)
Fe2O3 + 3H2 ----to---> 2Fe + 3H2O
Fe3O4 + 4H2 ----to---> 3Fe + 4H2O
Gọi x, y lần lượt là số mol Fe2O3 và Fe3O4
\(\left\{{}\begin{matrix}160x+232y=62,4\\3x+4y=2,2\end{matrix}\right.\)
Ra nghiệm âm, bạn xem lại đề câu này nhé
Sửa đề câu này số mol H2=1,1 (mol)
\(\left\{{}\begin{matrix}160x+232y=62,4\\3x+4y=1,1\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}x=0,1\\y=0,2\end{matrix}\right.\)
=> \(\%m_{Fe_2O_3}=\dfrac{0,1.160}{62,4}=25,64\%\)
\(\%m_{Fe_3O_4}=100-25,64=74,36\%\)
b \(n_{Fe}=2x+3y=2.0,1+3.0,2=0,8\left(mol\right)\)
=> \(m_{Fe}=0,8.56=44,8\left(g\right)\)
Câu 2: \(Zn+2HCl\rightarrow ZnCl_2+H_2\) (1)
\(Fe_2O_3+6HCl\rightarrow FeCl_3+3H_2O\) (2)
a) \(n_{H_2}=n_{Zn}=\dfrac{1,344}{22,4}=0,06\left(mol\right)\)
\(n_{HCl\left(1\right)}=2n_{H_2}=0,12\left(mol\right)\)
=> \(n_{Fe_2O_3}=\dfrac{7,1-0,06.65}{160}=0,02\left(mol\right)\)
\(n_{HCl\left(2\right)}=6n_{Fe_2O_3}=0,12\left(mol\right)\)
=> \(m_{HCl}=\left(0,12+0,12\right).36,5=8,76\left(g\right)\)
b) CuO + H2 ----to---> Cu + H2O
Fe3O4 + 4H2 ----to---> 3Fe + 4H2O
Bảo toàn nguyên tố H :\(n_{H_2}.2=n_{H_2O}.2\)
=> \(n_{H_2O}=0,06\left(mol\right)\)
Bảo toàn khối lượng: \(m_{\left(Cu+Fe\right)}=m_{\left(CuO+Fe_3O_4\right)}+m_{H_2}-m_{H_2O}\)
=> \(m_{\left(Cu+Fe\right)}=3,92+0,06.2-0,06.18=2,96\left(g\right)\)
\(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\)
\(n_{Fe}=\dfrac{a}{56}\left(mol\right)\)
PTHH:
6HCl+ 2Al ---> 2 AlCl3 + 3H2(1)
H2SO4 + Fe ---> FeSO4 + H2(2)
Theo PT (1) : \(n_{H_2}=1,5n_{Al}=0,3\left(mol\right)\)
=> \(m_{H_2}=0,3.2=0,6\left(mol\right)\)
Theo PT (2) : \(n_{H_2}=n_{Fe}=\dfrac{a}{56}\left(mol\right)\)
=> \(m_{H_2}=\dfrac{a}{56}.2=\dfrac{a}{28}\left(g\right)\)
m cốc đựng HCl tăng =mAl-mH2=5,4 - 0,6=4,8 (g)
m cốc đựng H2SO4 tăng=mFe - mH2=\(a-\dfrac{a}{28}\)(g)
Cân ở vị trí cân bằng
=> \(a-\dfrac{a}{28}=4,8\)
=> a=4,98 (g)
Đốt cháy sắt trong không khí, sau phản ứng thu được 62.4 gam hỗn hợp chất rắn A gồm Fe2O3 và Fe3O4 có tỉ lệ mol là 1:2.
- Tính khối lượng sắt tham gia phản ứng.
- Tính thể tích không khí cần để đốt cháy trong pư trên (coi O2 chiếm 20% thể tích kk)
Đốt m gam bột sắt trong khí oxi thu được 11,04 gam chất rắn X gồm Fe, Fe3O4, FeO, Fe2O3. Để hòa tan hoàn toàn hỗn hợp cần vừa hết 180 ml dung dịch H2SO4 1M, tạo thành 0,336 lít khí ở đktc. Tính m.
$n_{H_2SO_4} = 0,18(mol) \Rightarrow n_{H^+} = 0,18.2 = 0,36(mol)$
$n_{H_2} = \dfrac{0,336}{22,4} = 0,015(mol)$
$2H^+ + O^{2-} \to H_2O$
$2H^+ + 2e \to H_2$
Ta có :
$n_{H^+} = 2n_O + 2n_{H_2} \Rightarrow n_O = \dfrac{0,36 - 0,015.2}{2} = 0,165(mol)$
$\Rightarrow m = m_X - m_O = 11,04 - 0,165.16 = 8,4(gam)$