Trình bày sự giống và khác nhau của 3 loại liên kết: Liên kết ion, liên kết cộng hóa trị không cực và liên kết cộng hóa trị có cực.
Chương 3. Liên kết hóa học
So sánh | Liên kết ion | Liên kết cộng hóa trị không có cực | Liên kết cộng hóa trị có cực |
Giống nhau | Các nguyên tử kết hợp với nhau để tạo ra cho mỗi nguyên tử lớp electron ngoài cùng bền vững giống cấu trúc khí hiếm ( 2e hoặc 8e ). | ||
Khác nhau về cách hình thành liên kết | Cho và nhận electron | Dùng chung e, cặp e không bị lệch | Dùng chung e, cặp e bị lệch về phía nguyên tử có độ âm điện mạnh hơn. |
Khác nhau về nguyên tố tạo nên liên kết | Giữa kim loại và phi kim | Giữa các nguyên tử của cùng một nguyên tố phi kim | Giữa phi kim mạnh yếu khác nhau |
Nhận xét | Liên kết cộng hóa trị có cực là dạng trung gian giữa liên kết cộng hóa trị không cực và liên kết ion. | ||
Đúng 1
Bình luận (0)
Bạn nào trả lời giúp mình câu này với:
Cho 1 lá đồng có khối lượng là 6g vào dd AgNO3. Phản ứng xong, đem KL ra rửa nhẹ, làm khô cân được 13,6g
a) Viết PTHH
b) Tính khối lượng Cu đã phản ứng?
a/ Cu + AgNO\(_3\)-----> Ag + Cu(NO\(_3\))\(_2\)
Đúng 0
Bình luận (2)
PTHH: Cu + 2AgNO3 ------> Cu(NO3)2 +2Ag 64g 2.108g Khối lượng của Cu tăng theo pt là: 216-64=152g khối lượng của cu tăng theo bài ra là : 13,6 -6 =7,6g => nCu phản ứng= 7,6:152 = 0,05 mol =>mCu phản ứng = 0,05 .64 = 3,2g
Đúng 0
Bình luận (0)
Dựa vào hiệu độ âm điện của các nguyên tố, hãy cho biết loại liên kết trong các chất sau đây: AlCl3, CaCl2, CaS, Al2S3.
TL:
Hiệu độ âm điện giữa Al (1,61) và Cl (3,16) = 3,16 - 1,61 = 1,55 < 1,7 nên liên kết Al-Cl là liên kết cộng hóa trị phân cực.
CaCl2: Cl (3,16) - Ca (1,0) = 2,16 > 1,7 nên liên kết Ca-Cl là liên kết ion.
CaS: S(2,58) - Ca(1,0) = 1,58 < 1,7 nên liên kết Ca=S là liên kết cộng hóa trị phân cực.
Al2S3: S(2,58) - Al(1,61) = 0,97 < 1,7 nên liên kết Al-S là liên kết cộng hóa trị phân cực.
Chú ý: nếu hiệu độ âm điện nằm trong khoảng 0 đến 0,4 thì là liên kết CHT ko phân cực.
Đúng 1
Bình luận (0)
cho biết các loại liên kết hóa học trong các loại phân tử sau đây , giải thích : HF , Na2O , NaOH , NaF
HD:
Độ âm điện của các nguyên tố như sau: H(2,2); F(3,98); Na(0,93); O(3,44).
HF: Hiệu độ âm điện giữa F và H = 3,98 - 2,2 = 1,78 > 1,7 nên liên kết H-F là liên kết ion.
Na2O: Hiệu độ âm điện giữa O và Na = 3,44 - 0,93 = 2,95 > 1,7 nên liên kết O-Na là liên kết ion.
NaOH: Hiệu độ âm điện O-H = 3,44 - 2,2 = 1,24 < 1,7 nên liên kết O-H là liên kết cộng hóa trị phân cực.
NaF: Hiệu độ âm điện = 3,98 - 0,93 = 3,05 > 1,7 nên liên kết Na-F là liên kết ion.
Đúng 0
Bình luận (0)
X và Y là các nguyên tố thuộc phân nhóm chính, đều tạo hợp chất với hiđro có dạng RH (R là kí hiệu của nguyên tố X hoặc Y). Gọi A và B lần lượt là hiđroxit ứng với hóa trị cao nhất của X và Y. Trong B, Y chiếm 35,323% khối lượng. Trung hòa hoàn toàn 50 gam dung dịch A 16,8% cần 150 ml dung dịch B 1M. Xác định các nguyên tố X và Y.
Vì hợp chất với hidro có dạng RH => X hoặc Y thuộc nhóm IA hoặc VIIA
*TH1: Y thuộc nhóm IA => CT hidroxit : YOH
theo đề ta có: Y/(Y+17)=0.35323
=>Y=9.28 (loại)
*TH2: Y thuộc nhóm VIIA=> CT hidroxit: HYO4
theo đề ta có: Y/(1+Y+16.4)=0.35323
=> Y=35.5 Cl
theo đề ta thấy: trung hòa A cần dùng dung dịch B. Mà B là axit => A là bazo
=> X thuộc nhóm IA => CTHH: XOH
PT: XOH + HClO4 -> XClO4 +H2O
0.15 0.15 (MOL)
m(XOH)=(50.16,8)/100=8,4=>M(XOH)=m/n=56=>X=39 (Kali)
Đúng 0
Bình luận (1)
Hợp chất với hiđro có dạng RH nên Y có thể thuộc nhóm IA hoặc VIIA.
Trường hợp 1 : Nếu Y thuộc nhóm IA thì B có dạng YOH
Ta có : \(\frac{Y}{17}=\frac{35,323}{64,677}\Rightarrow\)\(Y=9,284\) (loại do không có nghiệm thích hợp)
Trường hợp 2 : Y thuộc nhóm VIIA thì B có dạng HYO4
Ta có : \(\frac{Y}{65}=\frac{35,323}{64,377}\Rightarrow Y=35,5\), vậy Y là nguyên tố clo (Cl).
B (HClO4) là một axit, nên A là một bazơ dạng XOH
\(m_A=\frac{16,8}{100}.50g=8,4g\)
XOH + HClO4 \(\rightarrow\) XClO4 + H2O
\(\Rightarrow n_A=n_{HClO_4}=0,15L.0,1\text{/}L=0,15mol\)
\(\Rightarrow M_X+17g\text{/}mol=\frac{0,84g}{0,15mol}\)
\(\Rightarrow\) MX = 39 gam/mol, vậy X là nguyên tố kali (K).
Đúng 0
Bình luận (0)
1.a. Sục từ từ khí Cl2 vào dung dịch KI, hãy cho biết màu sắc dung dịch biến đổi như thế nào? Giải thích.b. Hãy giải thích tại sao ái lực electron của flo (3,45 eV) bé hơn của clo (3,61 eV) nhưng tính oxi hóa của flo lại mạnh hơn của clo?2. Cho hỗn hợp gồm 0,03 mol Al, 0,02 mol Cu và 0,02 mol Zn tác dụng với hỗn hợp 2 axit H2SO4 và HNO3, sau phản ứng thu được 4,76 gam hỗn hợp khí SO2 và NO2 có thể tích là 1,792 lít (đo ở điều kiện tiêu chuẩn) và m gam muối (không có muối amoni). Tính m.
Đọc tiếp
>>
1.a. Sục từ từ khí Cl2 vào dung dịch KI, hãy cho biết màu sắc dung dịch biến đổi như thế nào? Giải thích.
b. Hãy giải thích tại sao ái lực electron của flo (3,45 eV) bé hơn của clo (3,61 eV) nhưng tính oxi hóa của flo lại mạnh hơn của clo?
2. Cho hỗn hợp gồm 0,03 mol Al, 0,02 mol Cu và 0,02 mol Zn tác dụng với hỗn hợp 2 axit H2SO4 và HNO3, sau phản ứng thu được 4,76 gam hỗn hợp khí SO2 và NO2 có thể tích là 1,792 lít (đo ở điều kiện tiêu chuẩn) và m gam muối (không có muối amoni). Tính m.
1. a. dd KI xuất hiện màu đỏ tím, sau đó dần trở lại không màu
Cl2 + 2KI \(\rightarrow\) 2KCl + I2 và 5Cl2 + I2 + 6H2O \(\rightarrow\) 2HIO3 + 10HCl
b. Quá trình chuyển X2 \(\rightarrow\) 2X- phụ thuộc vào 2 yếu tố: năng lượng phân li phân tử thành nguyên tử (tức năng lượng liên kết) và ái lực e để biến nguyên tử X thành ion X-
Mặc dù ái lực của flo bé hơn clo, nhưng năng lượng liên kết của flo lại thấp hơn của clo nên flo dễ phân li thành nguyên tử hơn, vì vậy tính oxi hóa của flo mạnh hơn clo
(Năng lượng liên kết của flo thấp hơn clo vì: Trong phân tử F chỉ có các AO p, không có AO trống \(\rightarrow\) phân tử F2 chỉ có liên kết \(\sigma\). Trong nguyên tử Cl, ngoài các AO p còn có AO d trống \(\rightarrow\) phân tử Cl2 ngoài sự xen phủ các AO p để tạo liên kết \(\sigma\), thì mây e còn đặt vào AO d trống, do đó tạo một phần liên kết pi).
2. Dựa vào thể tích và khối lượng hỗn hợp khí, lập hệ pt dễ dàng tính được số mol SO2 = 0,06 và NO2 = 0,02 \(\rightarrow\) số mol e nhận = 0,06.2 + 0,02 = 0,14
Nếu tất cả kim loại đều tan thì ne nhường = 0,03.3 + 0,02.2 + 0,02.2 = 0,17 > 0,14. Như vậy có kim loại còn dư, đó là Cu (vì Cu có tính khử yếu nhất), tính được số mol Cu dư = \(\frac{0,17-0,14}{2}\) = 0,015
Ta có : NO3- + 2H+ +1e \(\rightarrow\) NO2 + H2O
0,02 0,04
SO42- +4H+ +2e \(\rightarrow\) SO2 +2H2O
0,06 0,24
nNO3 -(muối) = nNO3- (ax) – nNO2 = nH+ - nNO2 = 0,04 – 0,02 = 0,02
Tương tự tính được nSO42- = 0,06 mol. Khối lượng muối = mkim loại + mgốc axit
\(\rightarrow\) m = 0,03.27 + 0.02.65 + 0,005.64 + 0,02.62 + 0,06.96 = 9,43 (gam)
Đúng 0
Bình luận (0)
Câu hỏi là : Hòa tan hết 11,2 gam hỗn hợp kim loại Cu và Ag trong dung dịch H2SO4 đặc nóng dư , thu được V lít khí SO2 dktc là sản phẩm khử duy nhất . Dẫn khí SO2 vào nước brom dư ,dung dịch thu được cho tác dụng với BaCl2 dư thì thu được 18,64 gam kết tủa .
Tính %(m) các kim loại trong hỗn hợp ?
nCu= x mol; nAg= y mol
Cu + 2H2SO4→ CuSO4 + SO2↑ + H2O (1)
2Ag + 2H2SO4→ Ag2SO4 + SO2↑ + 2H2O (2)
SO2(k) + Br2 + 2H2O → H2SO4 + 2HBr (3)
BaCl2 + H2SO4 → BaSO4↓ + 2HCl (4)
Theo PTPU (4), ta có: n↓= nBaSO4= nH2SO4 (4)= 0,08 mol
Theo PTPU (3), ta có: nSO2= nH2SO4 (4)= 0,08 mol
Theo PTPU (1) và (2), ta có: nSO2= nCu + 2nAg = x + 0,5y = 0,08 mol (5)
Tổng khối lượng hỗn hợp ban đầu: mhỗn hợp= mCu + mAg = 64x + 108y = 11,2 (6)
Giải hệ hai phương trình (5) và (6) ta được: x= 0,04 ; y= 0,08
→mCu= 0,04x64= 2,56 (g) →%mCu=2,56/11,2x100% = 22,86%
→%mAg= 100% - %mCu= 77,14%
Đúng 0
Bình luận (0)
Cho dãy oxit sau đây: Na2O, MgO, Al2O3, SiO2, P2O5, SO3, Cl2O7.
Dựa vào giá trị hiệu đọ âm điện của 2 nguyên tử trong phân tử hãy xác định loại liên kết trong từng phân tử oxit ( tra giá trị độ âm điện ở bảng 6, trang 45).
Na2O, MgO, Al2O3
SiO2, P2O5, SO3
Cl2O7
∆X
2,51 2,13 1,83
( Liên kết ion )
1,54 1,25 0,86
( Liên kết cộng hóa trị có cực)
0,28
(Liên kết cộng hóa trị không cực)
Đúng 0
Bình luận (2)
a) Dựa vào giá trị độ âm điện ( F: 3,98 ; O: 3,44 ; Cl: 3,16 ; N: 3,04) hãy xét xem tính phi kim thay đổi như thế nào của dãy nguyên tố sau: F, O, N, Cl.
b) Viết công thức cấu tạo của các phân tử sau đây:
N2, CH4, H2O, NH3
Xét xem phân tử nào có liên kết không phân cực, liên kết phân cực mạnh nhất.
F O Cl N
Độ âm điện: 3,98 3,44 3,16 3,14
Nhận xét: tính phi kim giảm dần.
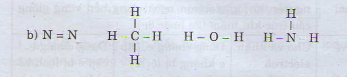
N2 CH4 H2O NH3
Hiệu độ âm điện: 0 0,35 1,24 0,84
Phân tử N2, CH4 có liên kết cộng hóa trị không phân cực. Phân tử H2O có liên kết cộng hóa trị phân cực mạnh nhất trong dãy.
Đúng 0
Bình luận (0)
Một nguyên tử có cấu hình electron 1s22s22p3
a) Xác định vị trí của nguyên tố đó trong bảng tuần hoàn, suy ra công thức phân tử của hợp chất khí với hidro
b) Viết công thức electron và công thức cấu tạo của phân tử đó.
a) Tổng số electron là 7, suy ra số thứ tự của nguyên tố là 7. Có 2 lớp electron suy ra nguyên tố ở chu kì 2. Nguyên tố p có 5 electron ở lớp ngoài cùng nên thuộc nhóm VA. Đó là ni tơ. Công thức phân tử hợp chất với hidro là NH3
b) Công thức electron và công thức cấu tạo của phân tử NH3
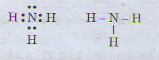
Đúng 0
Bình luận (0)















