Sulfuric acid là hoá chất quan trọng hàng đầu trong công nghiệp, được sử dụng cả ở dạng dung dịch loãng và dạng dung dịch đặc dựa trên những tính chất khác biệt. Vậy, dung dịch sulfuric acid loãng và dung dịch sulfuric acid đặc có những tính chất quan trọng nào? Cần lưu ý điều gì khi bảo quản và sử dụng acid này để đảm bảo an toàn?
Bài 8: Sulfuric acid và muối sulfate
Mở đầu (SGK Kết nối tri thức với cuộc sống trang 48)
Thảo luận (1)
Câu hỏi 1 (SGK Kết nối tri thức với cuộc sống trang 48)
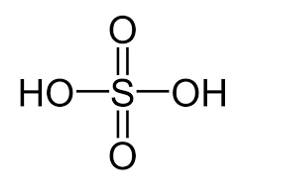
a) Dựa vào cấu tạo, cho biết phân tử sulfuric acid có khả năng cho bao nhiêu proton khi đóng vai trò là acid.
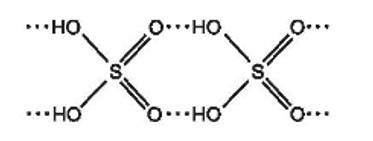
b) Dựa vào tương tác giữa các phân tử, hãy dự đoán sulfuric acid là chất lỏng dễ bay hơi hay khó bay hơi.
Thảo luận (1)Hướng dẫn giảia) Công thức cấu tạo của sulfuric acid:
Như vậy, phân tử sulfuric acid có khả năng cho 2 proton khi đóng vai trò là acid.
b) Với cấu tạo gồm các nguyên tử hydrogen linh động và các nguyên tử oxygen có độ âm điện lớn, giữa các phân tử sulfuric acid hình thành nhiều liên kết hydrogen:
Dự đoán sulfuric acid là chất lỏng, khó bay hơi.
(Trả lời bởi Quoc Tran Anh Le)
Câu hỏi 2 (SGK Kết nối tri thức với cuộc sống trang 50)
a) Nêu các lưu ý bắt buộc để đảm bảo an toàn khi sử dụng dung dịch sulfuric acid đặc.
b) Hãy cho biết ý nghĩa của kí hiệu cảnh báo ở Hình 8.3.
Thảo luận (1)Hướng dẫn giảia) Các lưu ý bắt buộc để đảm bảo an toàn khi sử dụng dung dịch sulfuric acid đặc:
(1) Sử dụng găng tay, đeo kính bảo hộ, mặc áo thí nghiệm.
(2) Cầm dụng cụ chắc chắn, thao tác cẩn thận.
(3) Không tì, đè chai đựng acid lên miệng cốc, ống đong khi rót acid.
(4) Sử dụng lượng acid vừa phải, lượng acid còn thừa phải thu hồi vào lọ đựng.
(5) Không được đổ nước vào dung dịch acid đặc.
b) Kí hiệu cảnh báo ở Hình 8.3 có ý nghĩa đây là hoá chất ăn mòn.
(Trả lời bởi Quoc Tran Anh Le)
Hoạt động 1+2 (SGK Kết nối tri thức với cuộc sống trang 50)
1. Em hãy cho biết các tính chất hóa học cơ bản của một acid.
2. Viết phương trình hóa học minh họa tính acid của dung dịch H2SO4 loãng với kim loại Fe, bột MgO, dung dịch Na2CO3, dung dịch BaCl2.
Thảo luận (1)Hướng dẫn giải1. Tính chất hóa học cơ bản:
+ Của axit mạnh: phản ứng nhanh với kim loại, dung dịch dẫn điện tốt, phản ứng được với muối cacbonat.
+ Của axit yếu: phản ứng chậm với kim loại, dung dịch dẫn điện kém, phản ứng được với muối cacbonat.
2.
PTHH:
\(H_2SO_4+Fe\rightarrow FeSO_4+H_2\\ H_2SO_4+MgO\rightarrow MgSO_4+H_2O\\H_2SO_4+Na_2CO_3\rightarrow Na_2SO_4+H_2O+CO_2\\ H_2SO_4+BaCl_2\rightarrow BaSO_4+2HCl \)
(Trả lời bởi Gia Huy)
Thí nghiệm (SGK Kết nối tri thức với cuộc sống trang 51)
Đồng (copper) tác dụng với dung dịch sulfuric acid đặc, nóng.Chuẩn bị: đồng lá hoặc phoi bào, dung dịch sulfuric acid 70%; ống nghiệm, kẹp gỗ, đèn cồn, bông tẩm dung dịch NaOH loãng.Tiến hành:- Cho vài lá đồng đã cắt nhỏ vào ống nghiệm, thêm tiếp khoảng 3 mL dung dịch H2SO4 70%, dùng bông đã tẩm dung dịch NaOH loãng nút miệng ống nghiệm.- Hơ nóng đều phần ống nghiệm chứa dung dịch trên ngọn lửa đèn cồn, sau đó đun tập trung vào đáy ống nghiệm.Lưu ý: Dung dịch sulfuric acid đặc rơi vào da sẽ gây...
Đọc tiếp
Đồng (copper) tác dụng với dung dịch sulfuric acid đặc, nóng.
Chuẩn bị: đồng lá hoặc phoi bào, dung dịch sulfuric acid 70%; ống nghiệm, kẹp gỗ, đèn cồn, bông tẩm dung dịch NaOH loãng.
Tiến hành:
- Cho vài lá đồng đã cắt nhỏ vào ống nghiệm, thêm tiếp khoảng 3 mL dung dịch H2SO4 70%, dùng bông đã tẩm dung dịch NaOH loãng nút miệng ống nghiệm.
- Hơ nóng đều phần ống nghiệm chứa dung dịch trên ngọn lửa đèn cồn, sau đó đun tập trung vào đáy ống nghiệm.
Lưu ý: Dung dịch sulfuric acid đặc rơi vào da sẽ gây bỏng nặng, cần cẩn thận khi sử dụng.
Quan sát, mô tả hiện tượng xảy ra và thực hiện yêu cầu sau:
1. Viết phương trình hoá học của phản ứng và xác định chất oxi hoá, chất khử.
2. Nhận xét về khả năng phản ứng của dung dịch sulfuric acid đặc, nóng với copper.
Thảo luận (1)Hướng dẫn giải1:
\(Cu+2H_2SO_4\left(đặc\right)\rightarrow CuSO_4+SO_2+2H_2O\)
Chất oxi hóa: H2SO4
Chất khử: Cu
2: Dung dịch H2SO4 đặc có tính oxi hóa mạnh, có thể oxi hóa kim loại hoạt động kém như đồng
(Trả lời bởi Nguyễn Lê Phước Thịnh)
Thí nghiệm (SGK Kết nối tri thức với cuộc sống trang 51)
Dung dịch sulfuric acid đặc tác dụng với đường míaChuẩn bị: đường mía (C12H22O11), dung dịch sulfuric acid đặc; cốc thuỷ tinh loại 100 mL.Tiến hành:- Lấy khoảng 10 g đường mía cho vào cốc.- Nhỏ đều trên bề mặt đường mía khoảng 2 mL dung dịch sulfuric acid đặc.Lưu ý: Dung dịch sulfuric acid đặc rơi vào da sẽ gây bỏng nặng, cần cẩn thận khi sử dụng.Quan sát, mô tả hiện tượng xảy ra và thực hiện yêu cầu sau:1. Viết phương trình hoá học của các phản ứng xảy ra trong thí nghiệm.2. Dự đoán hiện tượng...
Đọc tiếp
Dung dịch sulfuric acid đặc tác dụng với đường mía
Chuẩn bị: đường mía (C12H22O11), dung dịch sulfuric acid đặc; cốc thuỷ tinh loại 100 mL.
Tiến hành:
- Lấy khoảng 10 g đường mía cho vào cốc.
- Nhỏ đều trên bề mặt đường mía khoảng 2 mL dung dịch sulfuric acid đặc.
Lưu ý: Dung dịch sulfuric acid đặc rơi vào da sẽ gây bỏng nặng, cần cẩn thận khi sử dụng.
Quan sát, mô tả hiện tượng xảy ra và thực hiện yêu cầu sau:
1. Viết phương trình hoá học của các phản ứng xảy ra trong thí nghiệm.
2. Dự đoán hiện tượng khi cho dung dịch sulfuric acid đặc tiếp xúc với các carbohydrate khác như cellulose (giấy, bông), tinh bột (gạo).
Thảo luận (1)Hướng dẫn giảiHiện tượng: Đường mía dần dần hoá than, có hiện tượng sủi bọt đẩy cacbon trào ra ngoài cốc
1:
\(C_{12}H_{22}O_{11}\rightarrow12C+11H_2O\)
\(C+2H_2SO_4\left(đặc\right)\rightarrow CO_2+2SO_2+H_2O\)
2: Dự đoán: cellulose và tinh bột sẽ hóa đen bởi vì H2SO4 đặc có khả năng hút nước
(Trả lời bởi Nguyễn Lê Phước Thịnh)
Câu hỏi 3 (SGK Kết nối tri thức với cuộc sống trang 52)
a) Viết phương trình hoá học của phản ứng khi cho lần lượt các chất rắn sodium chloride (NaCl), sodium bromide (NaBr) tác dụng với dung dịch sulfuric acid đặc.
b) Chỉ ra vai trò của sulfuric acid trong mỗi phản ứng đó.
Thảo luận (1)Hướng dẫn giảia) Phương trình hoá học của phản ứng:
NaCl + H2SO4 (đặc) → NaHSO4 + HCl (1)
2NaBr + 3H2SO4 → 2NaHSO4 + Br2 + SO2 + 2H2O (2)
b) Phản ứng (1) không có sự thay đổi số oxi hoá của các nguyên tố, H2SO4 đặc đóng vai trò là acid.
Phản ứng (2) số oxi hoá của sulfur giảm từ +6 xuống +4, sulfuric acid đóng vai trò là chất oxi hoá.
(Trả lời bởi Quoc Tran Anh Le)
Hoạt động (SGK Kết nối tri thức với cuộc sống trang 52)
Sưu tầm tài liệu và trình bày về các ứng dụng của sulfuric acid trong các ngành sản xuất và đời sống. Vì sao sulfuric acid là hóa chất có tầm quan trọng bậc nhất?
Thảo luận (1)Hướng dẫn giảiMỗi năm cả thế giới cần đến hàng trăm triệu tấn sulfuric acid. Trong đó, gần \(50\%\) lượng acid được dùng để sản xuất phân bón như ammonium sulfate, calcium dihydrogenphosphate \(\left(Ca\left(H_2PO_4\right)_2\right),...\) Acid này còn được sử dụng trong sản xuất chất tẩy rửa, sơn, phẩm màu, thuốc trừ sâu, giấy, chế hoá dầu mỏ,…
Sulfuric acid là một hoá chất công nghiệp rất quan trọng, sản lượng sulfuric acid của mỗi quốc gia là một chỉ số tốt về sức mạnh công nghiệp của quốc gia đó vì thế sulfuric acid là hoá chất có tầm quan trọng bậc nhất.
(Trả lời bởi Mai Trung Hải Phong)
Câu hỏi 4 (SGK Kết nối tri thức với cuộc sống trang 52)
Dung dịch sulfuric acid đặc được sử dụng để sản xuất phosphoric acid và phân bón superphosphate từ quặng phosphorita và apatite. Hãy viết phương trình hoá học của phản ứng giữa dung dịch sulfuric acid đặc với Ca3(PO4)2 trong hai quặng trên.
Thảo luận (2)Hướng dẫn giảiPhương trình hóa học:
\(Ca_3\left(PO_4\right)_2+2H_2SO_{4\left(đặc\right)}\rightarrow Ca\left(H_2PO_4\right)_2+2CaSO_4.\)
\(Ca_3\left(PO_4\right)_2+3H_2SO_{4\left(đặc\right)}\rightarrow2H_3PO_4+3CaSO_4.\)
(Trả lời bởi Mai Trung Hải Phong)
Hoạt động (SGK Kết nối tri thức với cuộc sống trang 53)
Tìm hiểu thêm và trình bày về các ứng dụng của muối sulfate mà em biết.
Thảo luận (1)Hướng dẫn giảiAmmonium sulfate ((NH4)2SO4) ở dạng tinh thể màu trắng, chủ yếu được dùng làm phân bón cung cấp đạm cho đất.
Magnesium sulfate (MgSO4) ở dạng tinh thể màu trắng, chủ yếu được sử dụng làm phân bón. Muối này còn được sử dụng làm thuốc để cung cấp magnesium cho cơ thể, giúp giảm các cơn đau cơ, giảm hiện tượng chuột rút. Mỗi phân tử magnesium sulfate có thể kết hợp với 7 phân tử nước để tạo MgSO4.7H2O. Vì vậy, magnesium sulfate còn được sử dụng làm chất hút ẩm, chất hút mồ hôi tay của các vận động viên thể dục dụng cụ.
Barium sulfate (BaSO4) ở dạng tinh thể màu trắng, được sử dụng rộng rãi trong các lĩnh vực như sơn, mực in, nhựa, lớp phủ, men, thuỷ tinh, khai thác khoáng sản, sản xuất các loại giấy trắng chất lượng cao. Trong y tế, barium sulfate là thành phần chính của thuốc cản quang trong kĩ thuật X-quang.
(Trả lời bởi Quoc Tran Anh Le)