Đun nóng NH4Cl (Hình 4.6) thấy có hiện tượng khói trắng trong ống nghiệm. Giải thích.

Đun nóng NH4Cl (Hình 4.6) thấy có hiện tượng khói trắng trong ống nghiệm. Giải thích.

Viết phương trình hoá học khi cho dung dịch (NH4)2CO3 tác dụng với các dung dịch KOH, HCl, Ba(OH)2, CaCl2.
Thảo luận (1)Hướng dẫn giải\(\left(NH_4\right)_2CO_3+2KOH\rightarrow2NH_3\uparrow+K_2CO_3+2H_2O\\ \left(NH_4\right)_2CO_3+2HCl\rightarrow2NH_4Cl+CO_2+H_2O\\ Ba\left(OH\right)_2+\left(NH_4\right)_2CO_3\rightarrow BaCO_3\downarrow+2NH_3+2H_2O\\ \left(NH_4\right)_2CO_3+CaCl_2\rightarrow CaCO_3+2NH_4Cl\)
(Trả lời bởi GV Nguyễn Trần Thành Đạt)
NH4HCO3 thường được dùng làm bột nở trong sản xuất bánh bao. Giải thích.
Thảo luận (1)Hướng dẫn giảiVì khi nấu, chất này bị nhiệt phân huỷ thành khí, làm mảnh nở mềm xốp
\(PTHH:NH_4HCO_3\rightarrow\left(t^o\right)NH_3\uparrow+CO_2\uparrow+H_2O\uparrow\)
(Trả lời bởi GV Nguyễn Trần Thành Đạt)
Tìm hiểu thông tin và nêu một số ứng dụng của ammonia trong đời sống và sản xuất.
Thảo luận (1)Hướng dẫn giảiMột số ứng dụng của ammonia:
- Dùng trong hệ thống làm lạnh trong công nghiệp.
- Sản xuất nitric acid (HNO3).
- Sản xuất phân đạm: NH4Cl, NH4NO3, (NH4)2SO4,… phân urea: (NH2)2CO.
- Thuốc nhuộm, chất cọ rửa bông, len và lụa.
- Ngành công nghiệp dầu khí sử dụng ammonia trung hòa các thành phần acid của dầu thô, bảo vệ thiết bị không bị ăn mòn.
- Sử dụng trong ngành công nghiệp khai thác các kim loại như copper, nickel từ quặng.
(Trả lời bởi Quoc Tran Anh Le)
Hãy giải thích vì sao các loại phân bón như NH4Cl, NH4NO3, (NH4)2SO4 không thích hợp bón cho đất chua.
Thảo luận (1)Hướng dẫn giảiMuối ammonia dễ tan trong nước, khi bón phân chứa NH4Cl, NH4NO3, (NH4)2SO4 các muối này phân li tạo ra ion NH4+. Ví dụ: NH4NO3 phân li tạo ion ammonium (NH4+) là một acid yếu, tạo môi trường acid, làm đất chua hơn.
(Trả lời bởi Quoc Tran Anh Le)
Liên kết hoá học trong phân tử NH3 là liên kết
A. cộng hoá trị có cực. C. cộng hoá trị không cực.
B. ion. D. kim loại.
Thảo luận (1)Hướng dẫn giảiLiên kết trong phân tử NH3 được hình thành bởi cặp electron dùng chung giữa nguyên tử N và các nguyên tử H. Do độ âm của N lớn hơn độ âm điện của H nên cặp electron dùng chung bị lệch về phía N.
Liên kết hoá học trong phân tử NH3 là liên kết cộng hóa trị phân cực.
→ Chọn A.
(Trả lời bởi Quoc Tran Anh Le)
Có thể nhận biết muối ammonium bằng cách cho muối tác dụng với dung dịch kiềm thấy thoát ra một chất khí. Chất khí đó là
A. NH3. B. H2. C. NO2. D. NO.
Thảo luận (1)Hướng dẫn giải
Khi thải rác thải sinh hoạt chứa một lượng lớn ion ammonium vào ao, hồ sẽ xảy ra quá trình oxi hoá ammonium thành ion nitrate dưới tác dụng của vi khuẩn. Quá trình này làm giảm oxygen hoà tan trong nước, gây ngạt cho sinh vật sống dưới nước. Người ta phải xử lí nguồn nước gây ô nhiễm đó bằng cách chuyển ion ammonium thành ammonia, rồi chuyển tiếp thành nitrogen không độc. Hãy đề xuất một số hóa chất để thực hiện quá trình trên và viết phương trình hoá học của các phản ứng xảy ra.
Thảo luận (1)Hướng dẫn giải
Cho cân bằng hoá học: 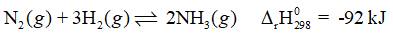
Cân bằng chuyển dịch theo chiều nào (có giải thích) khi:
a) tăng nhiệt độ.
b) tách ammonia ra khỏi hỗn hợp phản ứng.
c) giảm thể tích của hệ phản ứng.
Thảo luận (1)Hướng dẫn giảia) Phản ứng thuận là phản ứng tỏa nhiệt, phản ứng nghịch là phản ứng thu nhiệt. Khi tăng nhiệt độ, cân bằng chuyển dịch theo chiều làm giảm nhiệt độ (chiều tỏa nhiệt) → Cân bằng chuyển dịch theo chiều thuận.
b) Tách ammonia ra khỏi hỗn hợp phản ứng, làm giảm nồng độ ammonia. Cân bằng chuyển dịch theo chiều làm tăng nồng độ ammonia → Cân bằng chuyển dịch theo chiều thuận.
c) Giảm thể tích của hệ phản ứng tức là tăng áp suất của hệ. Cân bằng chuyển dịch theo chiều làm giảm áp suất của hệ (chiều giảm số mol khí) → Cân bằng chuyển dịch theo chiều thuận.
(Trả lời bởi Quoc Tran Anh Le)
Viết phương trình hoá học của các phản ứng xảy ra khi cho dung dịch (NH4)2SO4 tác dụng với dung dịch NaOH, dung dịch Ba(OH)2, dung dịch BaCl2, dung dịch Ba(NO3)2.
Thảo luận (1)Hướng dẫn giải