PTHH:
nCH2=CH–CH3 \(\overrightarrow{\text{ (nhiệt độ, xt, p) }}\) (-CH2–CH(CH3) -)n
Bài 13: Hydrocarbon không no
Đúng 0
Bình luận (0)
Các câu hỏi tương tự
Viết phương trình hoá học của phản ứng cháy hoàn toàn của alkane, alkene, alkyne ở dạng công thức tổng quát. So sánh tỉ lệ số mol carbon dioxide và nước tạo ra trong các trường hợp trên.
Viết phương trình hoá học và xác định sản phẩm chính trong mỗi phản ứng sau:
a) 2 – methylbut – 2 – ene phản ứng với HBr.
b) 2 – methylbut – 1 – ene phản ứng với nước (xúc tác H2SO4).
Ở nhiệt độ cao và có mặt của dung dịch sulfuric acid đặc, ethanol (CH3CH2OH) bị chuyển hoá thành ethylene và nước.
a) Viết phương trình hoá học của phản ứng xảy ra.
b) Vì sao cần dẫn khí từ ống nghiệm điều chế ethylene qua ống có chứa mẩu bông tẩm dung dịch NaOH đặc?
Cho các đoạn mạch polymer như ở dưới đây:
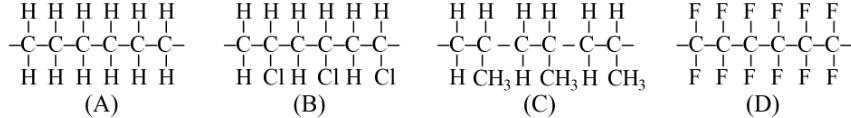
Viết phương trình hoá học tổng hợp các polymer ấy từ các alkene tương ứng.
Trong một phương pháp tổng hợp polyethylene (PE), các phân tử ethylene đã được hoà tan trong dung môi phản ứng với nhau để tạo thành polymer. Có thể sử dụng methyl alcohol, nước, cyclohexane hay hex – 1 – ene làm dung môi cho phản ứng trùng hợp PE được không? Giải thích.
Trình bày phương pháp hoá học để phân biệt các khí: ethane, ethylene và acetylene.
Viết công thức cấu tạo của sản phẩm chính tạo thành trong các phản ứng dưới đây:
a) CH ≡ CH + 2H2 \(\underrightarrow{Ni}\) ?
b) CH3 – C ≡ CH + 2HBr → ?
c) CH ≡ CH + 2Br2 → ?
Năng lượng liên kết của liên kết C – C (trong phân tử ethane) là 368 kJ mol-1 và năng lượng liên kết của liên kết C = C (trong phân tử ethene) là 636 kJ mol-1. Hãy cho biết liên kết nào (σ hay π) dễ bị bẻ gãy hơn khi phân tử tham gia phản ứng.
Cho biết công thức cấu tạo và tên gọi của alkene, alkyne mà khi hydrogen hoá tạo thành butane.




