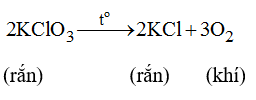Trong phòng thí nghiệm người ta có thể điều chế oxi bằng cách đốt nóng kali clorat:
Hãy dùng phương trình hóa học trên nên trả lời những câu hỏi sau:
a) Muốn điều chế được 4,48 lit khí oxi (đktc) cần dùng bao nhiêu gam KClO3 ?
b) Nếu có 1,5 mol KClO3 tham gia phản ứng, sẽ được bao nhiêu gam khí oxi?
c) Nếu có 0,1 mol KClO3 tham gia phản ứng, sẽ được bao nhiêu mol chất rắn và chất khí?
\(a.n_{O_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\\ \Rightarrow n_{KClO_3}=0,2.\dfrac{2}{3}=\dfrac{2}{15}\left(mol\right)\\ m_{KClO_3}=\dfrac{2}{15}.122,5\approx16,333\left(g\right)\\ b.n_{KClO_3}=1,5\left(mol\right)\Rightarrow n_{O_2}=\dfrac{3}{2}.1,5=2,25\left(mol\right)\\ m_{O_2}=2,25.32=144\left(g\right)\\ c.n_{KClO_3}=0,1\left(mol\right)\\ \Rightarrow n_{KCl}=n_{KClO_3}=0,1\left(mol\right);n_{O_2}=\dfrac{3}{2}.0,1=0,15\left(mol\right)\)