Dưới tác dụng của ánh sáng, nitric acid bị phân hủy tạo thành nitrogen dioxide (nhiệt độ thường)
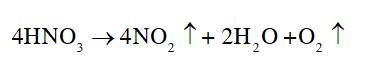
Dưới tác dụng của ánh sáng, nitric acid bị phân hủy tạo thành nitrogen dioxide (nhiệt độ thường)
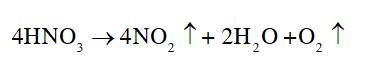
Trong công nghiệp, người ta sản xuất nitric acid (HNO3) từ ammonia theo sơ đồ chuyển hoá sau:
![]()
a) Viết các phương trình hoá học xảy ra.
b) Để điều chế 200 000 tấn nitric acid có nồng độ 60% cần dùng bao nhiêu tấn ammonia? Biết rằng hiệu suất của quá trình sản xuất nitric acid theo sơ đồ trên là 96,2%.
Viết các phương trình hoá học của chuỗi phản ứng tạo ra nitric acid từ nitrogen trong không khí.
N2→ NO→NO2→HNO3
Khí thải có chứa NO2 góp phần gây ra mưa acid và hiện tượng phú dưỡng. Giải thích.
Quan sát Hình 5.3, hãy nêu một số tác hại của mưa acid.

Quan sát Hình 5.2, mô tả quá trình hình thành mưa acid.
Viết phương trình hoá học của các phản ứng khi cho dung dịch HNO3 tác dụng với CuO, Ca(OH)2, CaCO3. Các phản ứng này có phải phản ứng oxi hoá — khử không? Giải thích.
Hãy tìm hiểu và cho biết hiện tượng nào trong tự nhiên và quá trình nào trong đời sống của con người là nguồn tạo ra các khí NO, NO2 trong không khí.
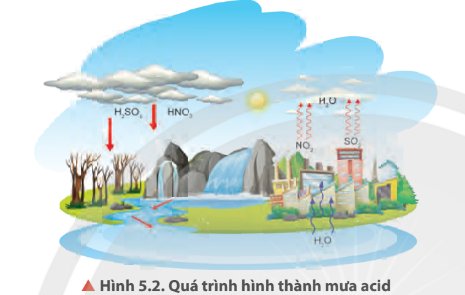
Quan sát Hình 5.4a, cho biết các liên kết hoá học giữa các nguyên tử trong phân tử HNO3 thuộc loại liên kết gì. Xác định số oxi hoá của nitrogen trong HNO3. Dự đoán vai trò của HNO3 trong các phản ứng oxi hoá — khử.
Hãy tìm hiểu và cho biết HNO3 được ứng dụng vào những lĩnh vực nào trong đời sống và sản xuất.