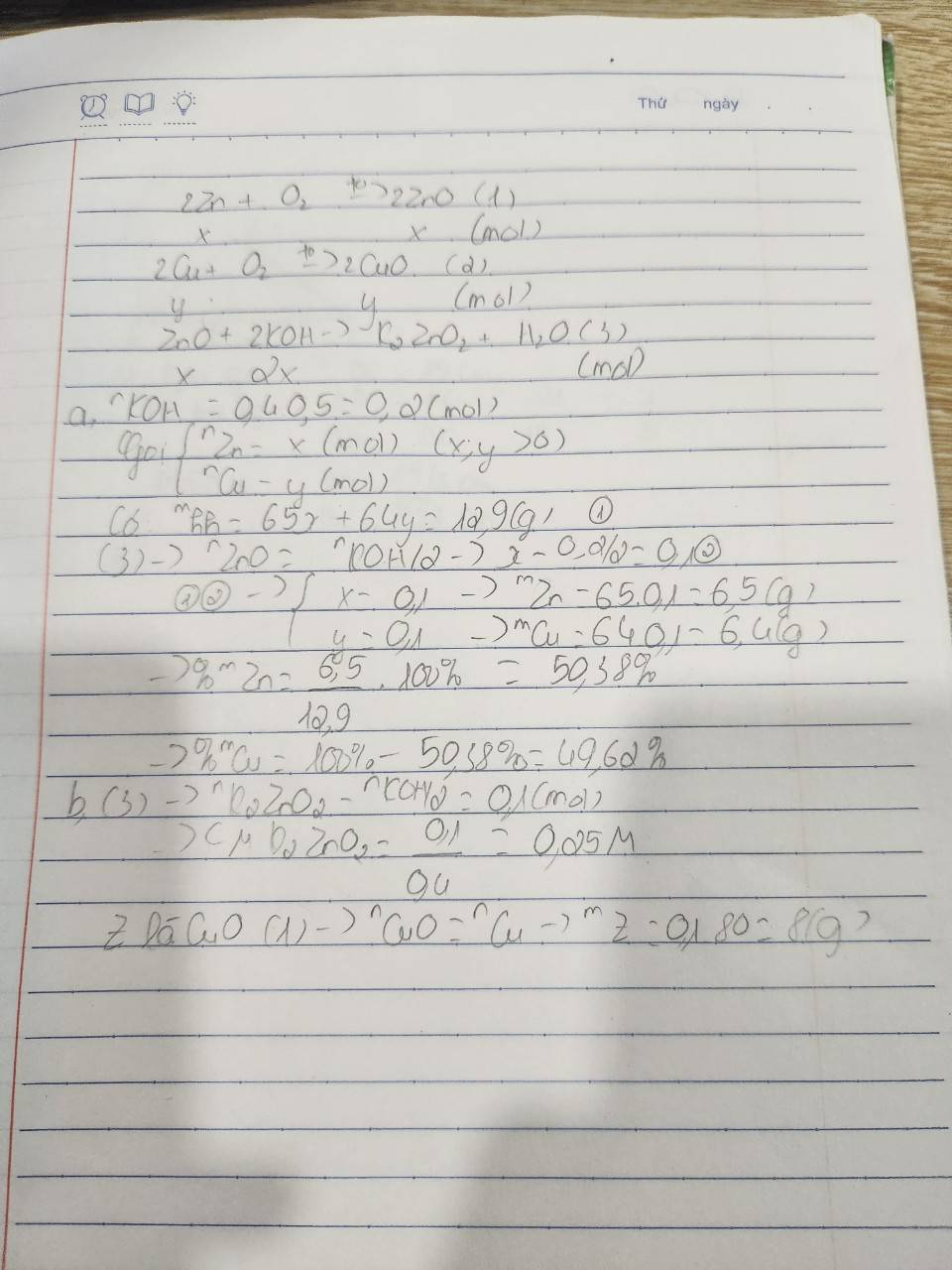Vì Cu là kim loại đứng sau Mg nên Cu k t/d vs axit
PTHH: Zn + H2SO4 → ZnSO4 + H2↑
Số mol của hiđrô là: 2,24 : 22,4 = 0,1 (mol)
Số mol của Zn là: 0,1 . 1 = 0,1(mol)
Khối lượng của Zn là: 0,1 . 65 = 6,5 (gam)
a) % Zn trong hỗn hợp ban đầu là:
(6,5 : 12,9) . 100% = 50,3876%
% Cu trong hỗn hợp ban đầu là:
100% - 50,3876% = 49,6124%
b) Số mol của axit là: 0,1 . 1 = 0,1(mol)
Khối lượng của axit là: 0,1 . 98 = 9,8 (gam)
C% = (9,8 : 400) . 100% = 2,45%
c) Tiếp theo áp dụng định luật bảo toàn khối lượng để tính khối lượng dung dịch muối sau phản ứng bằng cách Tính tổng khối lượng các chất phản ứng trừ đi khối lượng khí bay hơi... Từ đó ta tính được khối lượng dung dịch muối sau pứ là: 406,3(gam)
Khối lượng chất tan (khối lượng muối) là:
0,1 . 161 = 16,1 (gam)
C% của dung dịch muối sau pứ là:
16,1 : 406,3 = 3,9626%
được ko mấy pen
\(2Zn+O_2\underrightarrow{t^o}2ZnO\)
0,1 <--------- 0,1
\(2Cu+O_2\underrightarrow{t^o}2CuO\)
\(ZnO+2KOH\rightarrow K_2ZnO_2+H_2O\)
0,1<----- 0,2 --------> 0,1
\(n_{KOH}=0,4.0,5=0,2\left(mol\right)\)
\(X\left\{{}\begin{matrix}CuO\\ZnO\end{matrix}\right.+\underrightarrow{KOH}\left[{}\begin{matrix}Y:K_2ZnO_2\\Z:CuO\end{matrix}\right.\)
\(\%_{m_{Zn}}=\dfrac{65.0,1.100}{12,9}=50,39\%\)
\(\%_{m_{Cu}}=100\%-50,39\%=49,61\%\)
\(CM_{K_2ZnO_2}=\dfrac{0,1}{0,4}=0,25M\)
\(m_{Cu}=12,9-m_{Zn}=12,9-0,1.65=6,4\left(g\right)\Rightarrow n_{Cu}=\dfrac{6,4}{64}=0,1\left(mol\right)=n_{CuO}\)
\(m_Z=m_{CuO}=0,1.80=8\left(g\right)\)
Đề không đề cập axit, chỉ có câu a b bạn có nhầm gì không.