Hoà tan hết 7,74 gam hỗn hợp bột Mg, Al bằng 500 ml dung dịch hỗn hợp HCl 1M và H2SO4 loãng 0,28M thu được dung dịch A và 8,736 lít khí H2 ở 273k và 1atm.cho rằng các axit pư đồng thời vs 2 kim loại
a/tính khối lượng muối thu được sau pư
b/ cho dung dịch A tác dụng với V (l)dung dịch hỗn hợp gồm Naoh `1M và Ba(OH)2 0,5 M. Tính V để sau pư thu đc
*kết tủa max,tính khối lượng kết tủa max
* kết tủa min,tính khối lượng kết tủa min
P/S: mn giúp mk với nhá! mk cảm ơn rất nhiều.
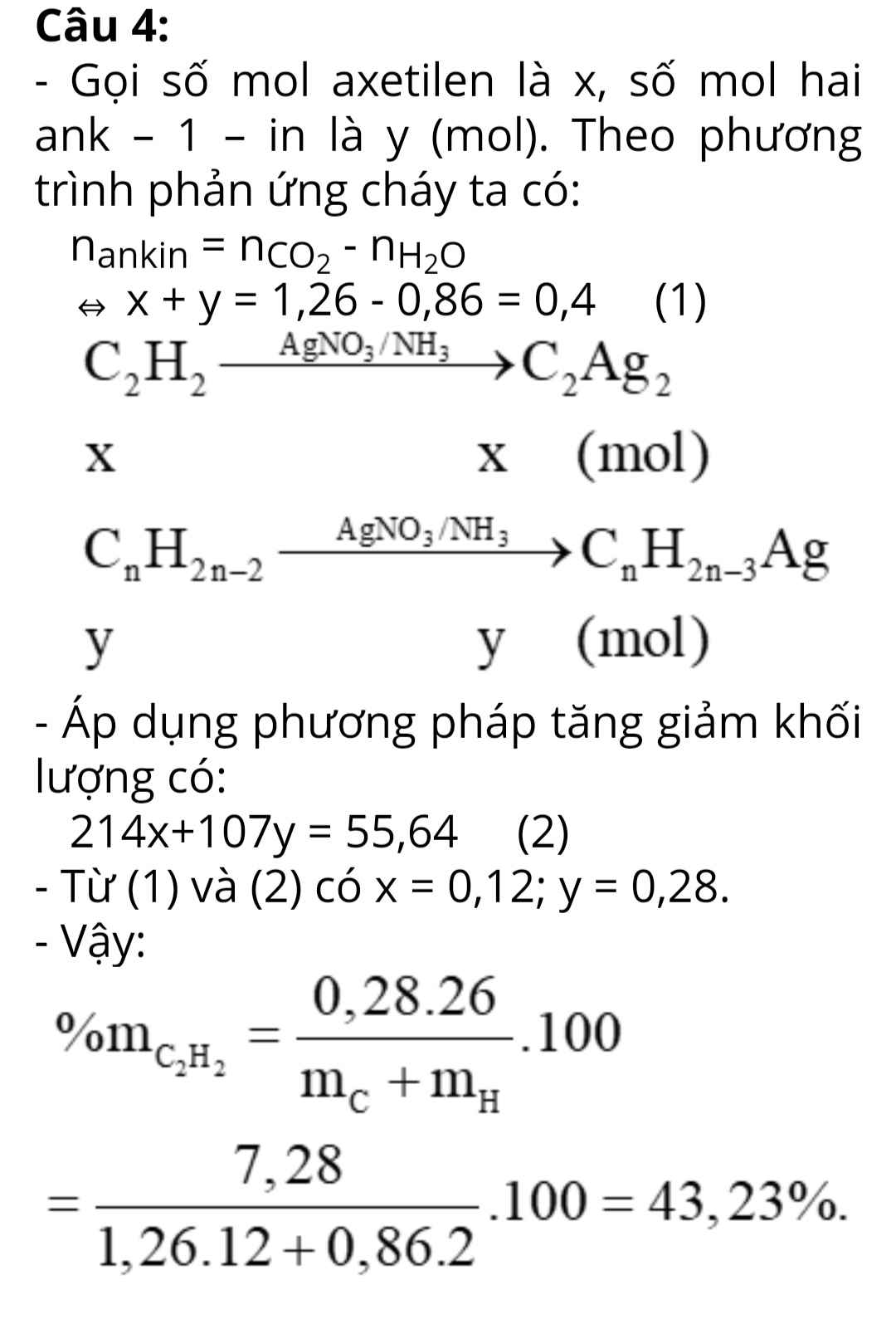
a) \(n_{H_2}=\dfrac{1.8,736}{0,082.273}=0,39\left(mol\right)\)
\(\left\{{}\begin{matrix}n_{HCl}=1.0,5=0,5\left(mol\right)\\n_{H_2SO_4}=0,28.0,5=0,14\left(mol\right)\end{matrix}\right.\)
Ta có: \(n_{H_2SO_4}+\dfrac{1}{2}.n_{HCl}=n_{H_2}\)
=> Pư vừa đủ
mmuối = 7,74 + 0,5.35,5 + 0,14.96 = 38,93 (g)
b)
A chứa \(\left\{{}\begin{matrix}Mg^{2+}:a\left(mol\right)\\Al^{3+}:b\left(mol\right)\\Cl^-:0,5\left(mol\right)\\SO_4^{2-}:0,14\left(mol\right)\end{matrix}\right.\)
Ta có: 24a + 27b = 7,74
Bảo toàn điện tích: 2a + 3b = 0,78
=> a = 0,12 (mol); b = 0,18 (mol)
\(\left\{{}\begin{matrix}n_{Na^+}=V\left(mol\right)\\n_{Ba^{2+}}=0,5V\left(mol\right)\\n_{OH^-}=2V\left(mol\right)\end{matrix}\right.\)
- Kết tủa max:
\(Mg^{2+}+2OH^-\rightarrow Mg\left(OH\right)_2\)
0,12---->0,24-------->0,12
\(Al^{3+}+3OH^-\rightarrow Al\left(OH\right)_3\)
0,18-->0,54-------->0,18
\(Ba^{2+}+SO_4^{2-}\rightarrow BaSO_4\)
0,14<----0,14---->0,14
=> \(n_{OH^-}=0,78\left(mol\right)\) => V = 0,39 (l)
mKT = 0,12.58 + 0,18.78 + 0,14.233 = 53,62 (g)
- Kết tủa min:
\(Mg^{2+}+2OH^-\rightarrow Mg\left(OH\right)_2\)
0,12---->0,24-------->0,12
\(Al^{3+}+3OH^-\rightarrow Al\left(OH\right)_3\)
0,18-->0,54-------->0,18
\(Ba^{2+}+SO_4^{2-}\rightarrow BaSO_4\)
0,14<----0,14---->0,14
\(Al\left(OH\right)_3+OH^-\rightarrow AlO_2^-+2H_2O\)
0,18---->0,18
=> nOH- = 0,96 (mol) => V = 0,48 (l)
mKT = 0,12.58 + 0,14.233 = 39,58 (g)