Zn: 0
H: 0
Cl: -1
O: -2
S: -2
H: +1; S: +6; O: -2
Na: +1; S: +2; O: -2
K: +1; N: +5; O: -2
Zn: 0
H: 0
Cl: -1
O: -2
S: -2
H: +1; S: +6; O: -2
Na: +1; S: +2; O: -2
K: +1; N: +5; O: -2
Tính số oxi hóa của nguyên tử có đánh dấu * trong các chất và ion dưới đây:

Quan sát Hình 12.2a, hydrogen cháy trong chlorine với ngọn lửa sáng, tạo hợp chất hydrogen chlorine (HCl). Nếu cặp electron chung trong hợp chất cộng hóa trị HCl lệch hẳn về phía nguyên tử Cl (Hình 12.2b), hãy xác định điện tích của các nguyên tử trong phân tử HCl.

Hãy nhận xét và giải thích sự thay đổi số oxi hóa của các nguyên tử trong chất oxi hóa và chất khử trước và sau phản ứng.
Dự đoán số oxi hóa của các nguyên tử trong nhóm IA, IIA, IIIA trong các hợp chất. Giải thích.
Nêu điểm khác nhau giữa kí hiệu số oxi hóa và kí hiệu điện tích của ion M trong hình sau: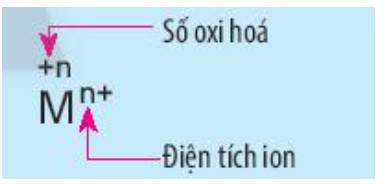
Magnetite là khoáng vật sắt từ có hàm lượng sắt cao nhất được dùng trong ngành luyện gang, thép, với công thức hóa học là Fe3O4.

Hãy xác định số oxi hóa của nguyên tử Fe trong hợp chất trên.
Lập phương trình hóa học của các phản ứng sau bằng phương pháp thăng bằng electron, nêu rõ chất oxi hóa, chất khử trong mỗi trường hợp:
a) \(HCl + Mn{O_2}\xrightarrow{{{t^o}}}MnC{l_2} + C{l_2} \uparrow + {H_2}O\)
b) \(KMn{O_4} + KN{O_2} + {H_2}S{O_4} \to MnS{O_4} + KN{O_3} + {K_2}S{O_4} + {H_2}O\)
c) \(F{e_3}{O_4} + HN{O_3} \to Fe{(N{O_3})_3} + NO \uparrow + {H_2}O\)
d) \({H_2}{C_2}{O_2} + KMn{O_4} + {H_2}S{O_4} \to C{O_2} \uparrow + MnS{O_4} + {K_2}S{O_4} + {H_2}O\)
Lập phương trình hóa học của phản ứng đốt cháy gas trong không khí và phản ứng kích nổ hỗn hợp nhiên liệu của tàu con thoi. Xác định vai trò của các chất trong mỗi phản ứng.
Lập phương trình hóa học của các phản ứng oxi hóa – khử sau, xác định vai trò của các chất tham gia phản ứng.
\(KMn{O_4} + HCl \to KCl + MnC{l_2} + C{l_2} \uparrow + {H_2}O(1)\)
\(N{H_3} + B{r_2} \to {N_2} + HBr(2)\)
\(N{H_3} + CuO\xrightarrow{{{t^o}}}Cu + {N_2} + {H_2}O(3)\)
\(Fe{S_2} + {O_2}\xrightarrow{{{t^o}}}F{e_2}{O_3} + S{O_2}(4)\)
\(KCl{O_3}\xrightarrow{{{t^o},Mn{O_2}}}KCl + {O_2} \uparrow \)(5)