Trước tiên ta cần chuyển đổi khối lượng các khí ra số mol phân tử. Số mol của các chất khí:
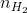 =
=  = 0,5 mol;
= 0,5 mol; 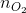 =
= 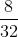 = 0,25 mol
= 0,25 mol
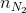 =
= 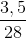 = 0,125 mol;
= 0,125 mol; 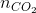 =
= 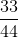 = 0,75 mol.
= 0,75 mol.
Tỉ lệ về số mol các khí cũng là tỉ lệ về thể tích các chất khí ở cùng một điều kiện, ta có sơ đồ biểu diễn:
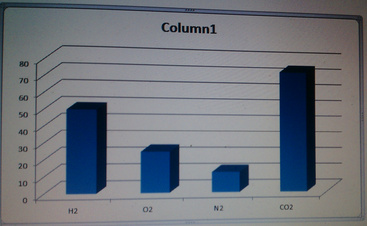

nH2 = 1 /2 = 0,5 mol nO2 = 8/32 = 0,25 mo nN2 = 3,5 / 28 = 0,125 mo nCO2 = 33 / 44 = 0,75mol Sơ đồ biểu thị về tỉ lệ thể tích của các khí (hình trên). Tỉ lệ số mol các chất khí cũng chính là tỉ lệ về thể tích các khí, nên thể tích khí Vco2 > VH2 > VO2 > VN2
Trước tiên ta cần chuyển đổi khối lượng các khí ra số mol phân tử. Số mol của các chất khí:
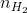 =
=  = 0,5 mol;
= 0,5 mol; 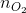 =
= 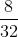 = 0,25 mol
= 0,25 mol
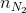 =
= 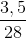 = 0,125 mol;
= 0,125 mol; 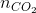 =
= 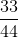 = 0,75 mol.
= 0,75 mol.
Tỉ lệ về số mol các khí cũng là tỉ lệ về thể tích các chất khí ở cùng một điều kiện, ta có sơ đồ biểu diễn:
nH2 = 1/2 = 0,5mol.
nO2 = 8/32 = 0,25 mol.
nN2 = 3,5/28 = 0,125 mol.
nCO2 = 33/44 = 0,75 mol.
Sơ đồ biểu thị về tỉ lệ thể tích cúa các khí.
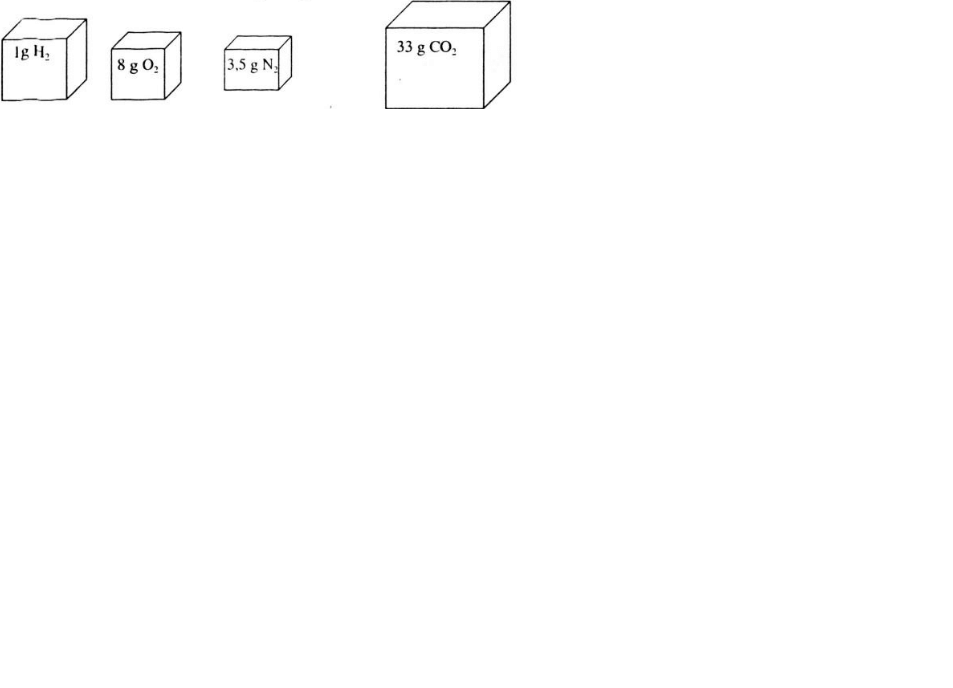
Tỉ lệ số mol các chất khí cũng chính là tỉ lệ về thể tích các khí nên thể tích khí VCO2 > VH2 > VO2> VN2.
Số mol các khí trên:
nH2 = \(\dfrac{m}{M}\) = \(\dfrac{1}{2}\) = 0,5 (mol)
nO2 = \(\dfrac{m}{M}\) = \(\dfrac{8}{32}\) = 0,25 (mol)
nN2 = \(\dfrac{m}{M}\) = \(\dfrac{3,5}{28}\) = 0,15 (mol)
nCO2 = \(\dfrac{m}{M}\) = \(\dfrac{33}{44}\) = 0,75 (mol)
Vì tỉ lệ số mol của các chất khí cũng là tỉ lệ về thể tích của các khí đó (Ở cùng một điều kiện)
Hình biểu diễn so sánh thể tích của các chất khí trên (theo thứ tự từ lớn đến bé):
Chúc bạn học tốt !!!

















