Bài 8: Quy tắc octet
Các câu hỏi tương tự
Vận dụng quy tắc octet, trình bày sơ đồ mô tả sự hình thành phân tử potassium chloride (KCl) từ nguyên tử của các nguyên tố potassium và chlorine.
Khi liên kết với nhau, nguyên tử của các nguyên tố dường như đã cố gắng “bắt chước” cấu hình electron nguyên tử của các nguyên tố khí hiếm để bền vững hơn. Điều này đã được nhà hóa học người Mỹ Lewis (Li-uýt, 1875 – 1946) đề nghị khi nghiên cứu về sự hình thành phân tử từ các nguyên tử. Ông gọi đó là quy tắc octet. Quy tắc octet là gì?
Đọc tiếp
Khi liên kết với nhau, nguyên tử của các nguyên tố dường như đã cố gắng “bắt chước” cấu hình electron nguyên tử của các nguyên tố khí hiếm để bền vững hơn. Điều này đã được nhà hóa học người Mỹ Lewis (Li-uýt, 1875 – 1946) đề nghị khi nghiên cứu về sự hình thành phân tử từ các nguyên tử. Ông gọi đó là quy tắc octet. Quy tắc octet là gì?
Giải thích sự hình thành liên kết trong phân tử H2O bằng cách áp dụng quy tắc octet.
Biết phân tử magnesium oxide hình thành bởi các ion Mg2+ và O2-. Vận dụng quy tắc octet, trình bày sự hình thành các ion trên từ những nguyên tử tương ứng.
Nguyên tử của nguyên tố nào sau đây có xu hướng đạt cấu hình electron bền vững của khí hiếm argon khi tham gia hình thành liên kết hóa học?
A. Fluorine
B. Oxygen
C. Hydrogen
D. Chlorine
Từ Hình 8.2, cho biết mỗi nguyên tử nitrogen đã đạt được cấu hình electron bền vững của nguyên tử khí hiếm nào.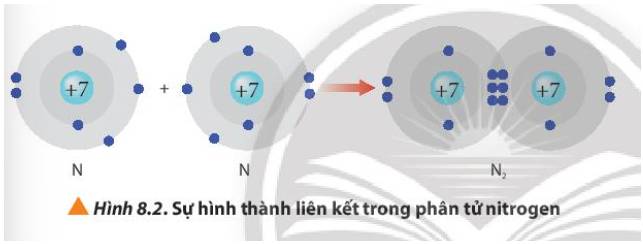
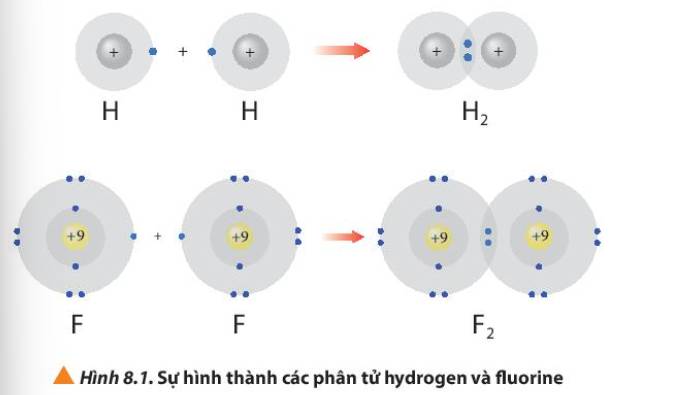
Nguyên tử của các nguyên tố hydrogen và fluorine có xu hướng cho đi, nhận thêm hay góp chung các electron hóa trị khi tham gia liên kết hình thành phân tử hydrogen fluoride (HF)?
Hình 8.1 giải thích sự hình thành phân tử hydrogen (H2) và fluorine (F2) từ các nguyên tử. Theo em, các nguyên tử hydrogen và fluorine đã “bắt chước” cấu hình electron của các nguyên tử khí hiếm nào khi tham gia liên kết?
Ion sodium và ion fluoride có cấu hình electron của các khi hiếm tương ứng nào?







