Orbital nguyên tử là khu vực không gian xung quanh hạt nhân mà tại đó xác suất có mặt (xác suất tìm thấy) electron khoảng 90%
⇒ Xuất phát từ mô hình nguyên tử hiện đại vì electron chuyển động không theo quỹ đạo, mật độ electron không giống nhau
Orbital nguyên tử là khu vực không gian xung quanh hạt nhân mà tại đó xác suất có mặt (xác suất tìm thấy) electron khoảng 90%
⇒ Xuất phát từ mô hình nguyên tử hiện đại vì electron chuyển động không theo quỹ đạo, mật độ electron không giống nhau
Quan sát Hình 4.1 và 4.2, so sánh điểm giống nhau và khác nhau giữa mô hình Rutherford – Bohr với mô hình hiện đại mô tả sự chuyển động của electron trong nguyên tử.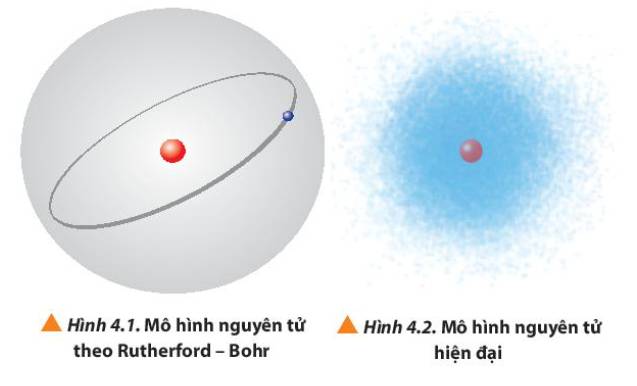
Quan sát Hình 4.3, phân biệt khái niệm đám mây electron và khái niệm orbital nguyên tử.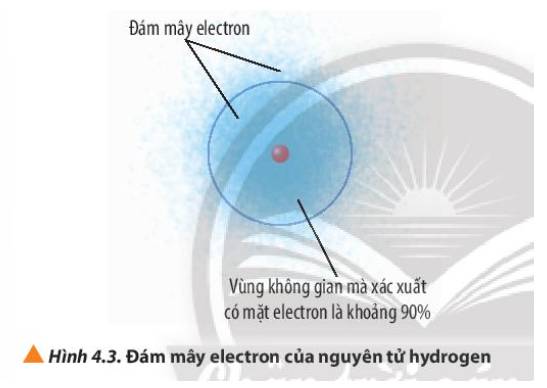
Viết cấu hình electron nguyên tử của nguyên tố aluminium (Z = 13) và biểu diễn cấu hình electron của aluminium theo ô orbital. Từ đó, xác định số electron độc thân của nguyên tử này.
Viết cấu hình electron nguyên tử của các nguyên tố: carbon (Z = 6), sodium (Z = 11) và oxygen (Z = 8). Cho biết số electron lớp ngoài cùng trong nguyên tử của các nguyên tố trên. Chúng là kim loại, phi kim hay khí hiếm.
Cấu hình electron của một nguyên tử cho biết những thông tin gì?
Hệ Mặt Trời gồm Mặt Trời ở trung tâm và các thiên thể quay quanh theo những quỹ đạo xác định. Hãy cho biết mô hình nguyên tử của nhà khoa học nào được gọi là mô hình hành tinh nguyên tử, tương tự như hệ Mặt Trời?
Cho nguyên tố X có 2 lớp electron, lớp thứ 2 có 6 electron. Xác định số hiệu nguyên tử của X.
Quan sát Hình 4.8, cho biết cách biểu diễn 2 electron trong một orbital dựa trên cơ sở nào.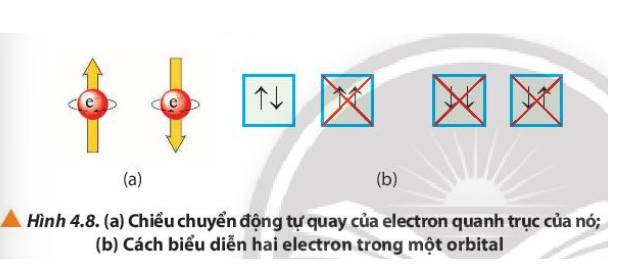
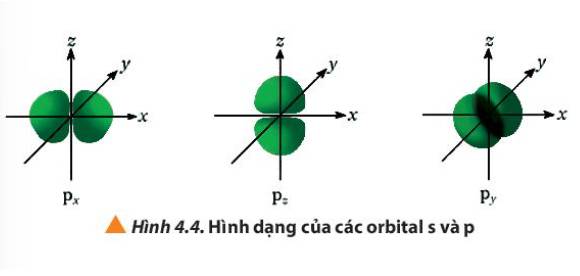
Quan sát Hình 4.4, hãy cho biết điểm giống và khác nhau giữa các orbital p (px, py, pz)