1. Cho 60,5g hỗn hợp hai kim loại Zn và Fe, trong đó Fe chiếm 46,289% về khối lượng tác dụng vừa đủ với 200g dung dịch HCl . a) tính C% của dung dịch HCl ban đầu và thể tích H2 thu được ở đktc, b) nồng độ phần trăm của các chất có trong dung dịch sau phản ứng
2. Cho m(g) hỗn hợp X gồm Al và Fe tác dụng vừa đủ với 250ml dung dịch H2SO4 loãng thu được 72,2g hỗn hợp muối và 12,32l khí (đktc) a) tính m, b) tính nồng độ mol dung dịch H2SO4 đã dùng, c) tính nồng độ mol của các chất tan có trong dung dịch sau phản ứng
Mình làm rồi nhưng không tự tin đáp án, các bạn giúp giùm mình với để mình so kết quả!! Pls
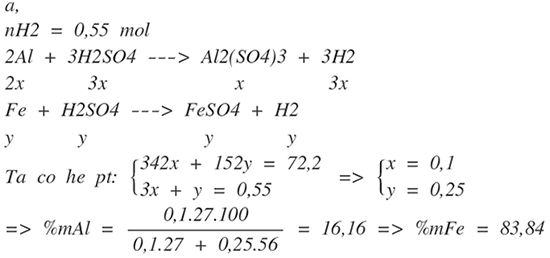
Câu b
Số mol của H2SO4 = 0,1.3 + 0,25 = 0,55
=> CM =\(\dfrac{\text{ 0,55}}{0,25}\) = 2,2
khối lượng Fe có trong hỗn hợp đầu là:
\(mFe=\dfrac{mh^2.\%mFe}{100\%}=\dfrac{60,5.46,289\%}{100\%}=28\left(g\right)\)
Số mol của kim loại Fe có trong hh
\(nFe=\dfrac{m}{M}=\dfrac{28}{56}=0,5\left(mol\right)\)
Khối lượng Zn có trong hh là:
\(mZn=mh^2-mFe=60,5-28=32,5\left(g\right)\)
số mol Zn là:
\(nZn=\dfrac{m}{M}=\dfrac{32,5}{65}=0,5\)(mol)
Ptr 1:\(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
.........1..........2..............1...........1
........0,5........1..............0,5........0,5
Ptr 2:\(Zn+2HCl\rightarrow ZnCl_2+H_2\uparrow\)
.........1..........2................1...........1
........0,5........1...............0,5........0,5
a.
m HCl=n.M = (0,5+0,5).36,5=36,5(g)
Nồng độ phần trăm chất tan của dd HCl là:
\(C\%=\dfrac{mct}{mdd}.100\%=\dfrac{36,5}{200}100\%=18,25\%\)
Thể tích H2 thu được là:
\(VH_2=n.22,4=\left(0,5+0,5\right).22,4=22,4\left(g\right)\)
b.
\(mFeCl_2=n.M=0,5\cdot127=63,5\left(g\right)\)
\(mZnCl_2=n.M=0,5\cdot136=68\left(g\right)\)
\(mH_2=n.M=1\cdot2=2\left(g\right)\)
Khối lượng dd thu được sau phản ứng là:
\(mdd=mh^2+mHCl-mH_2=60,5+200-2=258,2\left(g\right)\)
Nồng độ phần trăm FeCl2 có trong dd thu được là:
\(C\%=\dfrac{mFeCl_2}{mdd}.100\%=\dfrac{63,5}{258,5}=24,56\%\)
Nồng độ phần trăm ZnCl2 có trong dd thhu được là:\(C\%=\dfrac{mZnCl_2}{mdd}.100\%=\dfrac{68}{258,5}.100\%=26,31\%\)
Câu 1:
\(\text{a) }m_{Fe}=\dfrac{60,5\cdot46,289}{100}=28\left(g\right)\\ \Rightarrow m_{Zn}=60,5-28=32,5\left(g\right)\)
\(\Rightarrow n_{Fe}=\dfrac{m}{M}=\dfrac{28}{56}=0,5\left(mol\right)\\ n_{Zn}=\dfrac{m}{M}=\dfrac{32,5}{65}\left(mol\right)\)
\(pthh:Fe+2HCl\rightarrow FeCl_2+H_2\left(1\right)\\ Zn+2HCl\rightarrow ZnCl_2+H_2\left(2\right)\)
Theo \(pthh\left(1\right):n_{H_2\left(1\right)}=n_{Fe}=0,2\left(mol\right)\)
\(n_{HCl\left(1\right)}=2n_{Fe}=2\cdot0,2=0,4\left(mol\right)\)
Theo \(pthh\left(2\right):n_{H_2\left(2\right)}=n_{Zn}=0,2\left(mol\right)\)
\(n_{HCl\left(2\right)}=2n_{Zn}=2\cdot0,2=0,4\left(mol\right)\)
\(\Rightarrow\Sigma n_{H_2}=0,2+0,2=0,4\left(mol\right)\\ \Sigma n_{HCl}=0,4+0,4=0,8\left(mol\right)\)
\(\Rightarrow\Sigma V_{H_2}=\Sigma n\cdot22,4=0,4\cdot22,4=8,96\left(l\right)\\ \Sigma m_{HCl}=\Sigma n\cdot M=0,8\cdot36,5=29,2\left(g\right)\\ \Rightarrow C\%\left(HCl\right)=\dfrac{29,2\cdot100}{200}=14,6\left(\%\right)\)
b) Theo \(pthh\left(1\right):n_{FeCl_2}=n_{Fe}=0,2\left(mol\right)\)
Theo \(pthh\left(2\right):n_{ZnCl_2}=n_{Zn}=0,2\left(mol\right)\)
\(\Rightarrow m_{FeCl_2}=n\cdot M=0,2\cdot127=25,4\left(g\right)\\ m_{ZnCl_2}=n\cdot M=0,2\cdot136=27,2\left(g\right)\)
\(m_{H_2}=n\cdot M=0,4\cdot2=0,8\left(g\right)\\ m_{d^2\text{ }sau\text{ }pứ}=\left(m_{h^2\left(Fe+Zn\right)}+m_{d^2HCl}\right)-m_{H_2}\\ =\left(60,5+200\right)-0,8=259,7\left(g\right)\)
\(\Rightarrow C\%\left(FeCl_2\right)=\dfrac{25,4\cdot100}{259,7}=9,78\%\\ C\%\left(ZnCl_2\right)=\dfrac{27,2\cdot100}{259,7}=10,47\%\)
Câu 2:
a) \(n_{H_2}=\dfrac{V}{22,4}=\dfrac{12,32}{22,4}=0,55\left(mol\right)\)
\(pthh:Fe+H_2SO_4\rightarrow FeSO_4+H_2\left(1\right)\\ \text{ }\text{ }\text{ }\text{ }\text{ }\text{ }\text{ }\text{ }\text{ }\text{ }\text{ }\text{ }\text{ }\text{ }x\text{ }\text{ }\text{ }\text{ }\text{ }\text{ }\text{ }\text{ }\text{ }\text{ }\text{ }\text{ }x\text{ }\text{ }\text{ }\text{ }\text{ }\text{ }\text{ }\text{ }\text{ }\text{ }\text{ }\text{ }\text{ }\text{ }\text{ }x\text{ }\text{ }\text{ }\text{ }\text{ }\text{ }\text{ }\text{ }\text{ }\text{ }\text{ }x\\ 2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\left(2\right)\\ 2y\text{ }\text{ }\text{ }\text{ }\text{ }\text{ }\text{ }\text{ }\text{ }\text{ }\text{ }\text{ }\text{ }\text{ }3y\text{ }\text{ }\text{ }\text{ }\text{ }\text{ }\text{ }\text{ }\text{ }\text{ }\text{ }\text{ }\text{ }\text{ }\text{ }\text{ }\text{ }\text{ }\text{ }\text{ }\text{ }\text{ }\text{ }\text{ }\text{ }\text{ }\text{ }y\text{ }\text{ }\text{ }\text{ }\text{ }\text{ }\text{ }\text{ }\text{ }\text{ }\text{ }3y\)
Từ \(\left(1\right)\) và \(\left(2\right)\), ta có hệ phương trình: \(\left\{{}\begin{matrix}x+3y=0,55\\152x+342y=72,2\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=0,25\\y=0,1\end{matrix}\right.\)
\(\Rightarrow m_{Fe}=n\cdot M=0,25\cdot56=14\left(g\right)\\ m_{Al}=n\cdot M=0,1\cdot27=2,7\left(g\right)\)
\(\Rightarrow m_{h^2\left(Al+Fe\right)}=14+2,7=16,7\left(g\right)\)
b) \(n_{H_2SO_4}=x+3y=0,25+3\cdot0,1=0,55\left(mol\right)\)
\(\Rightarrow C_{M\left(H_2SO_4\right)}=\dfrac{n}{V}=\dfrac{0,3}{0,25}=1,2\left(M\right)\)
\(\text{c) }C_{M\left(FeSO_4\right)}=\dfrac{n}{V}=\dfrac{0,25}{0,25}=1\left(M\right)\\ C_{M\left(Al_2\left(SO_4\right)_3\right)}=\dfrac{n}{V}=\dfrac{0,1}{0,25}=0,4\left(M\right)\)















