Xin cách giải khác vs ạ
Cho hỗn hợp khí N2, H2 và NH3 có tỉ khối so với H2 là 8. Dẫn hỗn hợp đi qua dd H2SO4 đặc dư thì thể tích khí còn lại một nửa. Thành phần phần % theo thể tích của mỗi khí trong hỗn hợp lần lượt là:
Xin cách giải khác vs ạ
Cho hỗn hợp khí N2, H2 và NH3 có tỉ khối so với H2 là 8. Dẫn hỗn hợp đi qua dd H2SO4 đặc dư thì thể tích khí còn lại một nửa. Thành phần phần % theo thể tích của mỗi khí trong hỗn hợp lần lượt là:
Coi $n_{hh} = 1(mol)$
Khi cho qua dung dịch $H_2SO_4$ đặc, $NH_3$ bị hấp thụ
$2NH_3 + H_2SO_4 \to (NH_4)_2SO_4$
$\Rightarrow n_{NH_3} = \dfrac{1}{2}n_{hh} = 0,5(mol)$
$\Rightarrow \%V_{NH_3} = \dfrac{0,5}{1}.100\% = 50\%$
Gọi $n_{N_2} = a(mol) ; n_{H_2} = b(mol)$
$M_{hh} = 8.2 = 16(g/mol)$
Ta có : \(\dfrac{28a+2b+0,5.17}{a+b+0,5}=16\) và $a + b + 0,5 = 1$
Suy ra : a = b = 0,25
$\Rightarrow \%V_{N_2} = \%V_{H_2} = \dfrac{0,25}{1}.100\% = 25\%$
Cho hỗn hợp khí N2, H2 và NH3 có tỉ khối so với H2 là 8. Dẫn hỗn hợp đi qua dd H2SO4 đặc dư thì thể tích khí còn lại một nửa. Thành phần phần % theo thể tích của mỗi khí trong hỗn hợp lần lượt là:
Hỗn hợp khí đi qua H2SO4 đặc thì NH3 bị giữ lại. Khí thoát ra H2, N2
Gọi khối lượng phân tử trung bình của H2,N2 là ¯¯¯¯¯¯MM¯
Trong hỗn hợp khí NH3 chiếm 50%, (N2,H2) chiếm 50%
¯¯¯¯¯¯M+172=8.2=16→¯¯¯¯¯¯M=15M¯+172=8.2=16→M¯=15
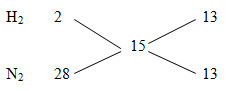
H2N2=11→%H2=%N2=25%
Hơi rắc rối tí nhé
Cho dd chứa amoni nitrat tác dụng vừa đủ với dd kiềm của kim loại hóa trị 2 thu được 4,48 lít khí ở đktc và dd X chứa 26,1 gam muối
\(n_{NH_3}=0,2\left(mol\right)\)
PTHH: \(M\left(OH\right)_2+2NH_4NO_3\rightarrow M\left(NO_3\right)_2+2H_2O+2NH_3\uparrow\)
0,1 ← 0,2
\(M_{M\left(NO_3\right)_2}=\dfrac{26,1}{0,1}=261\)
Lập phương trình: \(M+2\left(14+16\cdot3\right)=261\Leftrightarrow M=137\)
Vậy M là kim loại Bari, M(NO3)2 là muối Bari nitrat.
Hòa tan hoàn toàn m gam hỗn hợp 2 muối X và Y vào nước thu được dd A chứa: 0,2 mol Cu2+, x mol Fe3+, 0,3 mol Cl-, y mol NO3- . Cho m gam dd A tác dụng với dd NH3 dư thu được 10,7g kết tủa
a, X và Y có thể là muối nào
b, Tính giá trị của m
a) Bán PT phản ứng:
\(Cu^{2+}+2NH_3+2H_2O\rightarrow Cu\left(OH\right)_2\downarrow+2NH_4^+\\ Cu\left(OH\right)_2+4NH_3\rightarrow\left[Cu\left(NH_3\right)_4\right]\left(OH\right)_2\\ Fe^{3+}+3NH_3+3H_2O\rightarrow Fe\left(OH\right)_3\downarrow+3NH_4^+\)
Kết tủa thu được chỉ có \(Fe\left(OH\right)_3\)
\(\Rightarrow m_{Fe\left(OH\right)_3}=10,7\left(g\right)\Rightarrow n_{Fe\left(OH\right)_3}=\dfrac{10,7}{107}=0,1\left(mol\right)\)
=> x = nFe3+ = nFe(OH)3 = 0,1 (mol)
BTĐT: \(2n_{Cu^{2+}}+3n_{Fe^{3+}}=n_{Cl^-}+n_{NO_3^-}\)
=> 2.0,2 + 3.0,1 = 0,3 + y
=> y = 0,4 + 0,3 - 0,3 = 0,4 (mol)
Dễ dàng thấy được
\(\dfrac{n_{Fe^{3+}}}{n_{Cl^-}}=\dfrac{0,1}{0,3}=\dfrac{1}{3};\dfrac{n_{Cu^{2+}}}{n_{NO_3^-}}=\dfrac{0,2}{0,4}=\dfrac{1}{2}\)
=> 2 muối ban đầu là FeCl3, Cu(NO3)2
b) \(m=m_{Fe^{3+}}+m_{Cl^-}+m_{Cu^{2+}}+m_{NO_3^-}\)
=> m = 0,1.56 + 0,3.35,5 + 0,2.64 + 0,4.62 = 53,85 (g)
Cho V ml dd NH3 0,1M tác dụng với 100ml dd CuCl2 0,2M. Sau phản ứng thu được kết tủa X, lọc tác X rồi nung trong không khí đến khi khối lượng không đổi thu được 1,2 gam chất rắn màu đen. Giả thiết các p/ứ xảy ra hoàn toàn . Tính V
\(n_{CuO}=\dfrac{1,2}{80}=0,015\left(mol\right);n_{CuCl_2}=0,1.0,2=0,02\left(mol\right)\)
PTHH:
\(CuCl_2+2NH_3+2H_2O\rightarrow Cu\left(OH\right)_2\downarrow+2NH_4Cl\) (1)
Có thể có: \(Cu\left(OH\right)_2+4NH_3\rightarrow\left[Cu\left(NH_3\right)_4\right]\left(OH\right)_2\) (2)
\(Cu\left(OH\right)_2\xrightarrow[]{t^o}CuO+H_2O\) (3)
TH1: Không xảy ra phản ứng (2)
BTNT Cu: \(n_{CuCl_2\left(pứ\right)}=n_{CuO}=0,015\left(mol\right)< 0,02\left(mol\right)\left(tm\right)\)
Theo (1): \(n_{NH_3}=2n_{CuCl_2}=2.0,015=0,03\left(mol\right)\)
=> \(V_{dd.NH_3}=\dfrac{0,03}{0,1}=0,3\left(l\right)\)
TH2: Có xảy ra phản ứng (2)
Theo (3): \(n_{Cu\left(OH\right)_2\left(dư\right)}=n_{CuO}=0,015\left(mol\right)\)
Theo (1): \(n_{Cu\left(OH\right)_2\left(sinh.ra\right)}=n_{CuCl_2}=0,02\left(mol\right)\)
=> \(n_{Cu\left(OH\right)_2\left(2\right)}=0,02-0,015=0,005\left(mol\right)\)
Theo (1), (2): \(n_{NH_3}=2n_{CuCl_2}+4n_{Cu\left(OH\right)_2\left(2\right)}=0,06\left(mol\right)\)
=> \(V_{dd.NH_3}=\dfrac{0,06}{0,1}=0,6M\)
Cho dd A có chứa 0,15 mol AlCl3 và 0,15 mol FeCl2 tác dụng với NH3 dư sau đó lọc kết tủa rồi đem nung nóng trong không khí đến khối lượng không đổi thì thu được m gam chất rắn. Tính m
PTHH:
\(AlCl_3+3NH_3+3H_2O\rightarrow Al\left(OH\right)_3\downarrow+3NH_4Cl\\
FeCl_2+2NH_3+2H_2O\rightarrow Fe\left(OH\right)_2\downarrow+2NH_4Cl\\
2Al\left(OH\right)_3\xrightarrow[]{t^o}Al_2O_3+3H_2O\\
4Fe\left(OH\right)_2+O_2\xrightarrow[]{t^o}2Fe_2O_3+4H_2O\)
BTNT Al: \(n_{Al_2O_3}=\dfrac{1}{2}n_{Al}=0,075\left(mol\right)\)
BTNT Fe: \(n_{Fe_2O_3}=\dfrac{1}{2}n_{Fe}=0,075\left(mol\right)\)
=> m = 0,075.102 + 0,075.160 = 19,65 (g)
Cho 2,24 lít khí NH3 (đktc) đi qua ống đựng 16g CuO nung nóng thu được một chất rắn X.
a, Tính khối lượng CuO đã p/ứ
b, Tính thể tích dd HCl 2M đủ để tác dụng với X ?
a) $n_{NH_3} = \dfrac{2,24}{22,4} = 0,1(mol) ; n_{CuO} = \dfrac{16}{80} =0,2(mol)$
$2NH_3 + 3CuO \xrightarrow{t^o} 3Cu + N_2 + 3H_2O$
Ta thấy :
$n_{NH_3} : 2 < n_{CuO} : 3$ nên CuO dư
$n_{CuO\ pư} = \dfrac{3}{2}n_{NH_3} = 0,15(mol)$
$m_{CuO\ pư} = 0,15.80 = 12(gam)$
b)
$n_{CuO\ dư} = 0,2 - 0,15 = 0,05(mol)$
$CuO + 2HCl \to CuCl_2 + H_2O$
$n_{HCl} = 2n_{CuO\ dư} = 0,1(mol)$
$V_{dd\ HCl} =\dfrac{0,1}{2} = 0,05(lít)$
Cho 1 ít chất thị phenolphtalein vào dd NH3 loãng thu đc dd A. Màu dd A thay đổi thế nào khi:
a, Đun nóng dd 1 hồi lâu
b. Thêm một số mol HCl = số mol NH3 trong dd A
a) Ban đầu, dung dịch hóa đỏ. Sau khi đun nóng một lúc, $NH_3$ bay hơi dần nên dung dịch chuyển dần sang không màu
b) Ban đầu, dung dịch hóa đỏ. Sau khi cho HCl $(n_{HCl} = n_{NH_3}$ thì màu đỏ mất dần, chuyển sang dung dịch không màu.
$NH_3 + HCl \to NH_4Cl$
lấy dd cu(no3)2 thổi từ từ khí nh3 vào dd lúc đầu tạo kết tủa xanh A1, sau đó kết tủa tan hết tạo thành A2 có màu nước biển. Thêm khí HCl vào dd A2 thì lại thấy kết tủa xanh A1. Tiếp tục thổi khí HCl vào kết tủa A3 lại thấy kết tủa tan tạo dd xanh A4. Xác định A1, A2, A3, A4 Viết PTHH xảy ra
Đáng ra thổi HCl vào kết tủa A3
A1: Cu(OH)
A2: [Cu(NH3)4](OH)2
A3: Cu(OH)2
A4: CuCl2
\(Cu\left(NO_3\right)_2+2NH_3+2H_2O\rightarrow Cu\left(OH\right)_2\downarrow+2NH_4NO_3\)
\(Cu\left(OH\right)_2+4NH_3\rightarrow\left[Cu\left(NH_3\right)_4\right]\left(OH\right)_2\)
\(\left[Cu\left(NH_3\right)_4\right]\left(OH\right)_2+4HCl\rightarrow Cu\left(OH\right)_2\downarrow+4NH_4Cl\)
\(Cu\left(OH\right)_2+2HCl\rightarrow CuCl_2+2H_2O\)
Chọn 1 chất thích hợp để phân biệt các chất sau: NH4Cl, (NH4)2SO4, NaNO3, FeCl2, FeCl3, Al(NO3)3. Nêu cách tiến hành
_Trích mẫu thử, đánh STT_
- Cho dd Ba(OH)2 dư vào các mẫu thử, nếu thấy:
+ Mẫu thử có khí không màu, mùi khai thoát ra -> NH4Cl
\(Ba\left(OH\right)_2+2NH_4Cl\rightarrow BaCl_2+2NH_3\uparrow+2H_2O\)
+ Mẫu thử có khí không màu, mùi khai thoát ra và có kết tủa trắng -> (NH4)2SO4
\(Ba\left(OH\right)_2+\left(NH_4\right)_2SO_4\rightarrow BaSO_4\downarrow+2NH_3\uparrow+2H_2O\)
+ Mẫu thử tạo kết tủa màu trắng xanh sau đó hoá nâu đỏi ngoài không khí -> FeCl2
\(FeCl_2+2NaOH\rightarrow Fe\left(OH\right)_2\downarrow+2NaCl\\ 4Fe\left(OH\right)_2+O_2+2H_2O\rightarrow4Fe\left(OH\right)_3\downarrow\)
+ Mẫu thử tạo kết tủa màu nâu đỏ -> FeCl3
\(FeCl_3+3NaOH\rightarrow Fe\left(OH\right)_3\downarrow+3NaCl\)
+ Mẫu thử tạo kết tủa keo trắng sao đó kết tủa tan hết -> Al(NO3)3
\(2Al\left(NO_3\right)_3+3Ba\left(OH\right)_2\rightarrow2Al\left(OH\right)_3\downarrow+3BaCl_2\)
\(2Al\left(OH\right)_3+Ba\left(OH\right)_2\rightarrow Ba\left(AlO_2\right)_2+4H_2O\)
+ Mẫu thử không hiện tượng -> NaNO3
_Dán nhãn_