Trên chai đựng acetic acid đặc có các kí hiệu:
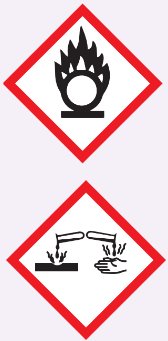
Nêu ý nghĩa của các kí hiệu trên. Cần phải làm gì khi sử dụng và lưu trữ acetic acid đặc?
Điều chế ethyl acetate bằng cách cho 6 gam acetic acid tác dụng với 5,2 gam ethanol có xúc tác là dung dịch sulfuric acid đặc và đun nóng thu được 5,28 gam ester. Tính hiệu suất của phản ứng.
\({{\rm{n}}_{{\rm{C}}{{\rm{H}}_{\rm{3}}}{\rm{COOH}}}}{\rm{ = }}\frac{{\rm{6}}}{{{\rm{60}}}}{\rm{ = 0,1 (mol); }}{{\rm{n}}_{{{\rm{C}}_2}{{\rm{H}}_5}{\rm{OH}}}}{\rm{ = }}\frac{{{\rm{5,2}}}}{{46}}{\rm{ }} \approx {\rm{ 0,113 (mol)}}\)
Phương trình hóa học:
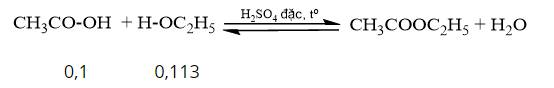
Ta có: \(\frac{{0,1}}{1} < \frac{{0,113}}{1}\) => acetic acid hết, ester tính theo acetic acid.
\(\begin{array}{l}{{\rm{n}}_{{\rm{C}}{{\rm{H}}_{\rm{3}}}{\rm{COO}}{{\rm{C}}_2}{{\rm{H}}_5}}}{\rm{ = }}{{\rm{n}}_{{\rm{C}}{{\rm{H}}_{\rm{3}}}{\rm{COOH}}}}{\rm{ = 0,1 (mol) }}\\ \Rightarrow {{\rm{m}}_{{\rm{C}}{{\rm{H}}_{\rm{3}}}{\rm{COO}}{{\rm{C}}_2}{{\rm{H}}_5}}} = {\rm{0,1}} \times {\rm{88 = 8,8 (g)}}\\ \Rightarrow {\rm{H = }}\frac{{5,28}}{{8,8}} \times 100\% = 60\% \end{array}\)
Sử dụng Hình 8.3 để trình bày về các ứng dụng của acetic acid.
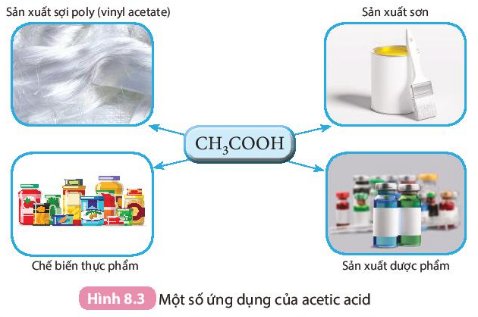
- Các ứng dụng của acetic acid:
+ Sản xuất sợi poly (vinyl acetate)
+ Sản xuất sơn
+ Chế biến thực phẩm
+ Sản xuất dược phẩm
1. Làm sao sản xuất acetic acid từ nguồn nguyên liệu là mật rỉ đường
2. Sử dụng mật rỉ đường có thể ảnh hưởng gì đến quá trình sản xuất citric acid?
Đun nóng 12 gam acetic acid với 13,8 gam ethanol (có dung dịch H2SO4 đặc làm xúc tác) thu được 11 gam ester. Tính hiệu suất của phản ứng ester hoá.
\(CH_3COOH+C_2H_5OH⇌\left(H^+,t^o\right)CH_3COOC_2H_5+H_2O\\ n_{CH_3COOH}=\dfrac{12}{60}=0,2\left(mol\right);n_{C_2H_5OH}=\dfrac{13,8}{46}=0,3\left(mol\right)\\ Vì:\dfrac{0,3}{1}>\dfrac{0,2}{1}\Rightarrow C_2H_5OH.dư\\ n_{CH_3COOC_2H_5\left(LT\right)}=n_{CH_3COOH}=0,2\left(mol\right)\\ n_{CH_3COOC_2H_5\left(TT\right)}=\dfrac{11}{88}=0,125\left(mol\right)\\ \Rightarrow H=\dfrac{0,125}{0,2}.100\%=62,5\%\)
Cho 50g dung dịch acetic acid CH3COOH tác dụng vùa đủ với 2,76 g Potassium carbonate K2CO3.
a. Tính nồng độ phần trăm dung dịch acetic acid đã dùng.
b. Nếu muốn thu được lượng acetic acid đã dùng ở trên thì càn len măn bao nhiều ml dung dịch ethanol 8 độ.
a, \(n_{K_2CO_3}=\dfrac{2,76}{138}=0,02\left(mol\right)\)
PT: \(2CH_3COOH+K_2CO_3\rightarrow2CH_3COOK+CO_2+H_2O\)
Theo PT: \(n_{CH_3COOH}=2n_{K_2CO_3}=0,04\left(mol\right)\)
\(\Rightarrow C\%_{CH_3COOH}=\dfrac{0,04.60}{50}.100\%=4,8\%\)
b, \(C_2H_5OH+O_2\underrightarrow{mengiam}CH_3COOH+H_2O\)
Theo PT: \(n_{C_2H_5OH}=n_{CH_3COOH}=0,04\left(mol\right)\Rightarrow m_{C_2H_5OH}=0,04.46=1,84\left(g\right)\)
\(\Rightarrow V_{C_2H_5OH}=\dfrac{1,84}{0,8}=2,3\left(ml\right)\)
\(\Rightarrow V_{C_2H_5OH\left(8^o\right)}=\dfrac{2,3}{8}.100=28,75\left(ml\right)\)
Cho 12 g acetic acid phản ứng với 12 g ethanol (có H2SO4 đặc làm xúc tác) thu được 8 g ester. Tính hiệu suất phản ứng ester hoá.
\(n_{CH_3COOH}=\dfrac{12}{60}=0,2\left(mol\right);n_{C_2H_5OH}=\dfrac{12}{46}=\dfrac{6}{23}\left(mol\right)\\ PTHH:CH_3COOH+C_2H_5OH⇌\left(H^+,t^o\right)CH_3COOC_2H_5+H_2O\\ Vì:0,2:1< \dfrac{6}{23}:1\Rightarrow Ethanol.dư\\ n_{este\left(LT\right)}=n_{acid}=0,2\left(mol\right)\\ n_{este\left(TT\right)}=\dfrac{8}{88}=\dfrac{1}{11}\left(mol\right)\\ \Rightarrow H=\dfrac{\dfrac{1}{11}}{0,2}.100\%\approx45,455\%\)
Câu 2: Acetic acid có thành phần % theo khối lượng các nguyên tố là: 40%C, 6,67%H, 53,33%O. Biết khối lượng mol của acetic acid là 60 g/mol. Hãy tìm công thức hóa học của acetic acid. ( C = 12, O = 16, H = 1)
Trong 1 mol acetic acid:
\(\left\{{}\begin{matrix}m_C=60.40\%=24\left(g\right)\\m_H=60.6,67\%=4\left(g\right)\\m_O=60-24-4=32\left(g\right)\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}n_C=\dfrac{24}{12}=2\left(mol\right)\\n_H=\dfrac{4}{1}=4\left(mol\right)\\n_O=\dfrac{32}{16}=2\left(mol\right)\end{matrix}\right.\)
Vậy CTHH là \(C_2H_4O_2\)
Nêu hiện tượng và viết pthh
1. Cho mẩu kim loại sodium (hoặc Potassium) vào rượu Ethanol
2.Thả mẩu kim loại Magesium Mg vào gốc đựng giấm (dd loãng của Acetic acid)
3.Cho Acetic acid vào ống nghiệm đựng bột CaO
1) Mẩu kim loại tan dần, có khí không màu thoát ra
2Na + 2C2H5OH --> 2C2H5ONa + H2
2K + 2C2H5OH --> 2C2H5OK + H2
2) Mẩu kim loại tan dần, có khí không màu thoát ra
Mg + 2CH3COOH --> (CH3COO)2Mg + H2
3) Bột CaO tan dần
CaO + 2CH3COOH --> (CH3COO)2Ca + H2O
Hãy viết công thức cấu tạo của acetic acid. Cho biết một số tính chất hoá học và ứng dụng của acetic acid mà em biết.
CTCT của acetic acid: \(CH_3-COOH\)
Một số tính chất hóa học:
- Hợp chất hữu cơ có tính axit mạnh, làm quỳ chuyển sang màu đỏ.
- Tác dụng được với kim loại trước H, oxit bazo, bazo, muối trung hòa, muối axit, rượu.
Ứng dụng của acetic acid:
- dung môi hòa tan các chất hóa học, sản xuất thuốc nhuộm, bảo quản thực phẩm...
Có 2 lọ đựng chất lỏng rượu etylic (c2h5oh) và acetic acid (ch3cooh). trình bày phương pháp hóa học khác nhau để phân biệt 2 chất lỏng đựng trong 2 bình trên.
Ta nhúm quỳ tím
-Quỳ chuyển đỏ là CH3COOH
-Quỳ ko chuyển màu là C2H5OH
Ta nhỏ NaOH có pha phenolpalein
-Mất màu khi nhỏ :CH3COOH
-ko hiện tượng C2H5OH
CH3COOH+NaOH->CH3COONa+H2O