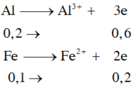cho 5,4 AL vào 200ml dd HCL sau phản ứng thu được V lít H2(đktc) a) tính giá trị V b) tính nồng độ CM của dung dịch HCl phản ứng Giúp mik vs ạ nếu có giải thì hãy giải giúp mik làm đầy đủ với ạ,mik c.ơn

Những câu hỏi liên quan
Hòa tan0,1 mol Al trong dd chứa 0,8mol hcl , sau phản ứng hoàn toán , thu được V lít khi H2(đktc). Giá trị của V là?
$2Al + 6HCl \to 2AlCl_3 + 3H_2$
Ta thấy :
$n_{Al} : 2 = 0,05 < n_{HCl} : 6$ nên HCl dư
$n_{H_2} = \dfrac{3}{2}n_{Al} = 0,15(mol)$
$\Rightarrow V = 0,15.22,4 = 3,36(lít)$
Đúng 0
Bình luận (0)
Cho hỗn hợp gồm 5,4 gam Al và 5,6 gam Fe phản ứng hoàn toàn với lượng dư dung dịch HCl, thu được V lít H2 (đktc). Giá trị của V là? A. 6,72. B. 10,08. C. 8,96. D. 11,2.
Đọc tiếp
Cho hỗn hợp gồm 5,4 gam Al và 5,6 gam Fe phản ứng hoàn toàn với lượng dư dung dịch HCl, thu được V lít H2 (đktc). Giá trị của V là?
A. 6,72.
B. 10,08.
C. 8,96.
D. 11,2.
Cho hỗn hợp gồm 5,4 gam Al và 5,6 gam Fe phản ứng hoàn toàn với lượng dư dung dịch HCl thu được V lít H2 (đktc). Giá trị của V là:
A. 6,72
B. 10,08
C. 8,96
D. 11,2
Đáp án C
nAl = 0,2, nFe = 0,1 (mol)
2Al + 6HCl→ 2AlCl3 + 3H2
0,2 → 0,3 (mol)
Fe + 2HCl→ FeCl2 + H2
0,1 0,1 (mol)
V = (0,3+0,1).22,4 = 8,96 (l)
Đúng 0
Bình luận (0)
Cho hỗn hợp gồm 5,4 gam Al và 5,6 gam Fe phản ứng hoàn toàn với lượng dư dung dịch HCl thu được V lít H2 (đktc). Giá trị của V là
A. 6,72
B. 10,08.
C. 8,96.
D. 11,2
Cho hỗn hợp gồm 5,4 gam Al và 5,6 gam Fe phản ứng hoàn toàn với lượng dư dung dịch HCl thu được V lít H2 (đktc). Giá trị của V là? A. 6,72 B. 10,08 C. 8,96 D. 11,2
Đọc tiếp
Cho hỗn hợp gồm 5,4 gam Al và 5,6 gam Fe phản ứng hoàn toàn với lượng dư dung dịch HCl thu được V lít H2 (đktc). Giá trị của V là?
A. 6,72
B. 10,08
C. 8,96
D. 11,2
Cho 7.2g mg vào 200ml dd hcl 1.5m sau khi phản ứng xảy ra hoàn toàn thu đc dd x và v lít khí ở đktc tính khối lượng muối tạo thành và giá trị của v?
Xem chi tiết
\(n_{Mg}=0,3\left(mol\right)\)
\(n_{HCl}=0,3\left(mol\right)\)
\(PTHH:Mg+2HCl\rightarrow MgCl_2+H_2\)
...............0,15......0,3..........0,15.....0,15......
- Thấy sau phản ứng HCl phản ứng hết, Mg còn dư ( dư 0,15 mol )
\(\Rightarrow\left\{{}\begin{matrix}m_M=m_{MgCl_2}=14,25\left(g\right)\\V=V_{H_2}=3,36\left(l\right)\end{matrix}\right.\)
Đúng 3
Bình luận (0)
PT: \(Mg+2HCl\rightarrow MgCl_2+H_2\)
Ta có: \(n_{Mg}=\dfrac{7,2}{24}=0,3\left(mol\right)\)
\(n_{HCl}=0,2.1,5=0,3\left(mol\right)\)
Xét tỉ lệ: \(\dfrac{0,3}{1}>\dfrac{0,3}{2}\), ta được Mg dư.
Theo PT: \(n_{MgCl_2}=n_{H_2}=\dfrac{1}{2}n_{HCl}=0,15\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}m_{MgCl_2}=0,15.95=14,25\left(g\right)\\V_{H_2}=0,15.22,4=3,36\left(l\right)\end{matrix}\right.\)
Bạn tham khảo nhé!
Đúng 2
Bình luận (0)
Hòa tan 13,9 g hh Al và Fe vào dd HCl dư thu được V lít khí H2 (đktc) và dd A. Cô cạn dd A thu được 38 g hh muối khan
a. Tính thành phần % khối lượng hh ban đầu và giá trị V
b. Tính khối lượng dd HCl 25% đã lấy biết dùng dư 20% so với lượng phản ứng
Xem chi tiết
a)Gọi x,y lần lượt là số mol của Al, Fe trong hỗn hợp ban đầu (x,y>0)
Sau phản ứng hỗn hợp muối khan gồm: \(\left\{{}\begin{matrix}AlCl_3:x\left(mol\right)\\FeCl_2:y\left(mol\right)\end{matrix}\right.\)
Ta có hệ phương trình: \(\left\{{}\begin{matrix}27x+56y=13,9\\133,5x+127y=38\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x\approx0,0896\\y\approx0,205\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Al}=\dfrac{0,0896\cdot27\cdot100\%}{13,9}\approx17,4\%\\\%m_{Fe}=\dfrac{0,205\cdot56\cdot100\%}{13,9}\approx82,6\%\end{matrix}\right.\)
Theo Bảo toàn nguyên tố Cl, H ta có:\(n_{H_2}=\dfrac{n_{HCl}}{2}=\dfrac{3n_{AlCl_3}+2n_{FeCl_2}}{2}\\ =\dfrac{3\cdot0,0896+2\cdot0,205}{2}=0,3394mol\\ \Rightarrow V_{H_2}=0,3394\cdot22,4\approx7,6l\)
Đúng 2
Bình luận (0)
Cho 5,4 gam Al tác dụng vừa đủ với 150ml dung dịch HCl aM. Sau phản ứng thu được m gam muối khan và V lít H2(đktc).
a. Giá trị của a là:
A. 3M B. 4M C. 1,5M D. 2,5M
b. Khối lượng muối khan m là:
A. 26,7g B. 15,45g C. 22,1g D. 18,4g
c. Thể tích khí H2 (V) là:
A. 13,44l B. 2,24l C. 6,72l D. 3,36l
Đọc tiếp
Cho 5,4 gam Al tác dụng vừa đủ với 150ml dung dịch HCl aM. Sau phản ứng thu được m gam muối khan và V lít H2(đktc). a. Giá trị của a là: A. 3M B. 4M C. 1,5M D. 2,5M b. Khối lượng muối khan m là: A. 26,7g B. 15,45g C. 22,1g D. 18,4g c. Thể tích khí H2 (V) là: A. 13,44l B. 2,24l C. 6,72l D. 3,36l
\(\text{Ta có PTHH}\\2Al+6HCl \rightarrow 2AlCl_3+3H_2 \uparrow\\n_{Al}=\dfrac{5,4}{27}=0,2(mol)\\\Rightarrow n_{HCl}=3n_{Al}=0,6(mol)\\\Rightarrow C_{M_{HCl}}=n/V=\dfrac{0,6}{0,15}=4(M)\\\text{ Câu hỏi 1 : B}\\\Rightarrow n_{AlCl_3}=n_{Al}=0,2(mol)\\\Rightarrow m_{AlCl_3} = 0,2.133,5=26,7(gam)\\\text{ Câu hỏi 2 : A}\\\Rightarrow n_{H_2}=3/2n_{Al}=0,3(mol)\Rightarrow V_{H_2}(đktc)=0,3.22,4=6,72(lít)\\\text{ Câu hỏi 3 : C} \)
Đúng 1
Bình luận (0)
Câu 8: Cho 14,3 g hon hop 3 kim loại Al, Zn,Mg vào dd HCl du. Phản ứng xảy ra hoàn toàn, sau
phản ứng thu được 49,8 g muối clorua và V lít khi H2 thoát ra ở đktc. Tinh giá trị V.
Muối = Kim loại + gốc Cl
➝ Khối lượng của gốc Cl là: mCl = 49,8 - 14,3 = 35,5 gam
➝ nCl = nHCl = 35,5/35,5 = 1 mol
Khi viết phương trình ra sẽ thấy mối liên hệ: nHCl = 2nH2
➝ nH2 = 0,5 mol ➝ VH2 = 0,5.22,4 = 11,2 lít
Đúng 1
Bình luận (0)
m Cl=49,8-14,3=35,5g
=>n Cl=1 mol
=>n H2=1\2n Cl=0,5 mol
=>V=0,5.22,4=11,2l
Đúng 0
Bình luận (0)