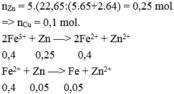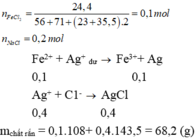Lấy 19,3 g hh bột gồm Zn và Cu có tỉ lệ mol tương ứng là 1 : 2 vào dd chứa 0,2 mol Fe2(SO4)3 . Sau khi các PƯ xảy ra hoàn toàn, thu được m (g) kim loại. Tính m?

Những câu hỏi liên quan
Cho 22,65 gam hh bột gồm Zn và Cu có tỉ lệ mol tương ứng là 5:2 vào dd chứa 0,2 mol Fe2(SO4)3. Sau khi các pư xảy ra hoàn toàn, thu được m gam kim loại. Giá trị của m là
A. 12,80.
B. 9,20.
C. 6,40.
D. 16,53.
Cho 19,3 gam hỗn hợp bột gồm Zn và Cu có tỉ lệ mol tương ứng là 1 : 2 vào dung dịch chứa 0,2 mol Fe2(SO4)3. Sau khi các phản ứng xảy ra hoàn toàn, thu được m gam kim loại. Giá trị của m là A. 6,40 B. 16,53 C. 12,00 D. 12,80
Đọc tiếp
Cho 19,3 gam hỗn hợp bột gồm Zn và Cu có tỉ lệ mol tương ứng là 1 : 2 vào dung dịch chứa 0,2 mol Fe2(SO4)3. Sau khi các phản ứng xảy ra hoàn toàn, thu được m gam kim loại. Giá trị của m là
A. 6,40
B. 16,53
C. 12,00
D. 12,80
Cho 19,3 gam hỗn hợp bột gồm Zn và Cu có tỉ lệ mol tương ứng là 1 : 2 vào dung dịch chứa 0,2 mol Fe2(SO4)3. Sau khi các phản ứng xảy ra hoàn toàn, thu được m gam kim loại. Giá trị của m là
A. 16,53.
B. 6,40.
C. 12,80.
D. 12,00.
Đáp án B
Đặt nZn = x mol ; nCu =2x mol
=> m hỗn hợp = 65x +64.2x =19,3 g => x = 0,1 mol
Có nFe3+ = 0,4 mol ,Xảy ra các quá trình sau:
Zn + 2Fe3+ → Zn 2+ + 2Fe2+
Mol 0,1 -> 0,2
Cu +2 Fe3+ → Cu 2+ + 2Fe2+ Mol 0,1 <- 0,2
=> m = mCu dư = 0,1 .64 = 6,4g
Đúng 0
Bình luận (0)
Cho 19,3 g hh gồm Zn và Cu có tỉ lệ số mol tương ứng là 1:2 vào dd chứa 0,2 mol Fe2(SO4)3. Sau khi phản ứng xảy ra hoàn toàn, thu được m gam kim loại. Hỏi m?
\(3Zn+Fe_2\left(SO_4\right)_3\rightarrow3ZnSO_4+2Fe\)
x -------------0,2---------------------------\(\dfrac{2x}{3}\) (mol)
\(3Cu+Fe_2\left(SO_4\right)_3\rightarrow3CuSO_4+2Fe\)
2x -----------0,2------------------------------\(\dfrac{4x}{3}\) (mol)
Gọi x(mol) là số mol của Zn và Fe
Theo đề bài ta có:
\(m_{Zn}+m_{Cu}=m_{hh}\)
⇔ 65 . x + 64 . 2x = 19,3
⇔ x = 0,1(mol)
⇒ \(\left\{{}\begin{matrix}n_{Zn}=0,1\left(mol\right)\\n_{Cu}=0,2\left(mol\right)\end{matrix}\right.\)
\(n_{Fe}=\dfrac{2x}{3}+\dfrac{4x}{3}=\dfrac{2.0,1}{3}+\dfrac{4.0,2}{3}=0,33\left(mol\right)\)
\(m_{Fe}=n.M=0,33.56=18,48\left(g\right)\)
\(m_{Fe_2\left(SO_4\right)_3}=n.M=0,2.400=80\left(g\right)\)
Ta có: \(m_{hh}+m_{Fe_3\left(SO_4\right)_3}=m_{kl}+m_{Fe}\)
⇔ \(m_{kl}\) = 19,3 + 80 - 18,48 = 80,82(g)
Đúng 0
Bình luận (2)
Cho 19,3g hỗn hợp bột gồm Zn và Cu có tỉ lệ mol tương ứng là 1:2 vào dd chứa 0,2 mol Fe2(SO4)3. Sau khi các pư xảy ra hoàn toàn, thu được m gam kim loại. Giá trị của m là
Đặt nZn = x (mol) và nCu = 2x (mol)
(Vì hỗn hợp bột gồm Zn và Cu có tỉ lệ về số mol là 1:2)
⇒ mhỗn hợp = mZn + mCu
= 65x + 64 × 2x) = 19,3 g
⇒ x = 0,1 mol
Có nFe3+ = 0,4 mol. Xảy ra các quá trình sau:
PTHH: Zn + 2Fe3+ → Zn2+ + 2Fe2+
TPT: 1mol 2mol
TĐB: 0,1 → ?(mol)
=>nFe3+ = \(\dfrac{0,1.2}{1}\) = 0,2(mol)
PTHH: Cu + 2Fe3+ → Cu2+ + 2Fe2+
TPT: 1mol 2mol
TĐB: ?(mol) ← 0,2(mol)
=> nCu= \(\dfrac{0,2.1}{2}=0,1\left(mol\right)\)
⇒ m = mCu dư = 0,1 × 64 = 6,4 g
Đúng 0
Bình luận (0)
cho 15,6 g hh gồm kim loại M (hóa trị II) và Al (có tỉ lệ mol tương ứng là 1:2) vào bình đựng 13,44 lít khí Cl2 (đktc), sau khi các pư hoàn toàn thu được hh chất rắn X. Cho X tan hết trong dd HCl dư thu được 4,48 lít khí H2 (đktc) thoát ra.a) xác định kim loại Mb) mặt khác, hòa tan hoàn toàn 0,1 mol M và 0,2 mol Al vào dd HNO3 loãng dư, sau pư khối lượng dd tăng thêm 7,8g. Tính số mol HNO3 đã tham gia pư
Đọc tiếp
cho 15,6 g hh gồm kim loại M (hóa trị II) và Al (có tỉ lệ mol tương ứng là 1:2) vào bình đựng 13,44 lít khí Cl2 (đktc), sau khi các pư hoàn toàn thu được hh chất rắn X. Cho X tan hết trong dd HCl dư thu được 4,48 lít khí H2 (đktc) thoát ra.
a) xác định kim loại M
b) mặt khác, hòa tan hoàn toàn 0,1 mol M và 0,2 mol Al vào dd HNO3 loãng dư, sau pư khối lượng dd tăng thêm 7,8g. Tính số mol HNO3 đã tham gia pư
a) \(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
Gọi \(\left\{{}\begin{matrix}n_M=a\left(mol\right)\\n_{Al}=2a\left(mol\right)\end{matrix}\right.\)
=> a.MM + 54a = 15,6 (1)
\(n_{Cl_2}=\dfrac{13,44}{22,4}=0,6\left(mol\right)\)
M0 - 2e --> M+2
a--->2a
Al0 - 3e --> Al+3
2a-->6a
Cl20 + 2e --> 2Cl-1
0,6-->1,2
2H+1 + 2e --> H20
0,4<--0,2
Bảo toàn e: 2a + 6a = 1,6
=> a = 0,2
Thay vào (1) => MM = 24 (g/mol)
=> M là Mg
b) Xét \(m_{Mg}+m_{Al}=0,1.24+0,2.27=7,8\left(g\right)\)
=> Không có khí thoát ra
=> pư tạo ra sản phẩm khử là NH4NO3
PTHH: 4Mg + 10HNO3 --> 4Mg(NO3)2 + NH4NO3 + 3H2O
0,1---->0,25
8Al + 30HNO3 --> 8Al(NO3)3 + 3NH4NO3 + 9H2O
0,2--->0,75
=> nHNO3 = 0,25 + 0,75 = 1 (mol)
Đúng 3
Bình luận (0)
Hoà tan hoàn toàn 24,4 gam hh gồm FeCl2 và NaCl (có tỉ lệ số mol tương ứng là 1:2) vào một lượng nước (dư), thu được dd X. Cho dd AgNO3 (dư) vào dd X, sau khi pư xảy ra hoàn toàn sinh ra m gam chất rắn. Giá trị của m là A. 57,4 B. 28,7 C. 10,8 D. 68,2
Đọc tiếp
Hoà tan hoàn toàn 24,4 gam hh gồm FeCl2 và NaCl (có tỉ lệ số mol tương ứng là 1:2) vào một lượng nước (dư), thu được dd X. Cho dd AgNO3 (dư) vào dd X, sau khi pư xảy ra hoàn toàn sinh ra m gam chất rắn. Giá trị của m là
A. 57,4
B. 28,7
C. 10,8
D. 68,2
cho 18,6 g hh A gồm Zn và Fe vào dd chứa 0,5a mol HCl. Khi PƯ xảy ra hoàn toàn, cô cạn dd thu được 34,575 g chất rắn. Lập lại thí nghiệm trên với dd chứa a mol HCl rồi cô cạn thì thu được 39,9 g chất rắn. Tính a và khối lượng mỗi kim loại trong 18,6 g hh A
Do ở TN2, khi tăng lượng HCl, khối lượng rắn tăng thêm
=> Trong TN1, HCl hết, kim loại dư
- Xét TN1
Theo ĐLBTKL: mA + mHCl = mrắn sau pư + mH2
=> 18,6 + 36,5.0,5a = 34,575 + 2.0,25a
=> a = 0,9
- Xét TN2:
Giả sử HCl hết
Theo ĐLBTKL: 18,6 + 0,9.36,5 = 39,9 + 0,45.2
=> 51,45 = 40,8 (vô lí)
=> HCl dư, kim loại hết
Gọi số mol Zn, Fe là a, b
=> 65a + 56b = 18,6
PTHH: Zn + 2HCl --> ZnCl2 + H2
a--------------->a
Fe + 2HCl --> FeCl2 + H2
b---------------->b
=> 136a + 127b = 39,9
=> a = 0,2 ; b = 0,1
=> \(\left\{{}\begin{matrix}m_{Zn}=0,2.65=13\left(g\right)\\m_{Fe}=0,1.56=5,6\left(g\right)\end{matrix}\right.\)
Đúng 3
Bình luận (0)
Cho hỗn hợp gồm Mg và Zn có tỉ lệ mol tương ứng 2 : 1 vào 500 ml dung dịch Fe2(SO4)3 0,2M và CuSO4 0,3M. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch Y và m gam rắn Z. Cho dung dịch NaOH dư vào dung dịch Y, lấy kết tủa nung ngoài không khí đến khối lượng không đổi, thu được 15,2 gam hỗn hợp chứa 2 oxit. Giá trị của m là A. 12,88 gam B. 13,32 gam C. 17,44 gam D. 9,60 gam
Đọc tiếp
Cho hỗn hợp gồm Mg và Zn có tỉ lệ mol tương ứng 2 : 1 vào 500 ml dung dịch Fe2(SO4)3 0,2M và CuSO4 0,3M. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch Y và m gam rắn Z. Cho dung dịch NaOH dư vào dung dịch Y, lấy kết tủa nung ngoài không khí đến khối lượng không đổi, thu được 15,2 gam hỗn hợp chứa 2 oxit. Giá trị của m là
A. 12,88 gam
B. 13,32 gam
C. 17,44 gam
D. 9,60 gam