cần bao nhiêu gam Na tan hoàn toàn trong 33,46 gam H2O để tạo ra dung dịch bazơ 8%

Những câu hỏi liên quan
Hoà tan hoàn toàn 6,2 gam hỗn hợp hai kim loại Na. K trong H2O dư thấy tạo ra 2,24 lít khí H2 (đktc). Cô cạn dung dịch sau phản ứng thu được m gam hiđroxit, giá trị của m là
A. 7,90.
B. 13,50.
C. 9,60.
D. 15,10.
Cho hai mẩu Fe có khối lượng bằng nhau. Cho một mẩu hoà tan hoàn toàn trong dung dịch HCl tạo 19,05 gam muối. Cho mẩu còn lại tan hoàn toàn trong dung dịch H 2 SO 4 loãng thì khối lượng muối sunfat tạo ra là bao nhiêu ?
Phương trình hóa học của phản ứng:
Fe + 2HCl → Fe Cl 2 + H 2
Fe + H 2 SO 4 → FeSO 4 + H 2
Qua các phương trình hóa học trên và dữ liệu đề bài, ta có:
n FeCl 2 = 19,05/127 = 0,15 mol = n Fe
m FeSO 4 = 0,15 x 152 = 22,8g
Đúng 0
Bình luận (0)
Bài 3: Hòa tan hoàn toàn 8 gam MgO bằng 200 ml dung dịch HCl . a/ Tính nồng độ mol dung dịch HCl cần dùng. b/ Tính khối lượng muối tạo thành.
c/ Cần dùng bao nhiêu ml dd AgNO3 0,5 M để tác dụng hết với lượng muối sinh ra ở phản ứng trên? d/ Tính khối lượng kết tủa thu được.
Hòa tan 3,2 gam SO3 tác dụng với nước dư thu được dung dịch A.
a/ Tính khối lượng axit sunfuric tạo thành trong dung dịch A.
b/ Hòa tan hoàn toàn 0,69 gam Na vào dung dịch A, tính khối lượng các chất trong dung dịch sau phản ứng.
c/ Hòa tan hoàn toàn 2,07 gam Na vào dung dịch A, tính khối lượng các chất trong dung dịch sau phản ứng.
a) \(n_{SO_3}=\dfrac{3,2}{80}=0,04\left(mol\right)\)
PTHH: SO3 + H2O --> H2SO4
0,04------------->0,04
=> \(m_{H_2SO_4}=0,04.98=3,92\left(g\right)\)
b) \(n_{Na}=\dfrac{0,69}{23}=0,03\left(mol\right)\)
PTHH: 2Na + 2H2O --> 2NaOH + H2
0,03------------>0,03
2NaOH + H2SO4 --> Na2SO4 + 2H2O
Xét tỉ lệ: \(\dfrac{0,03}{2}< \dfrac{0,04}{1}\)=> NaOH hết, H2SO4 dư
2NaOH + H2SO4 --> Na2SO4 + 2H2O
0,03------>0,015---->0,015
\(\left\{{}\begin{matrix}n_{Na_2SO_4}=0,015\left(mol\right)\\n_{H_2SO_4\left(dư\right)}=0,025\left(mol\right)\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}m_{Na_2SO_4}=0,015.142=2,13\left(g\right)\\m_{H_2SO_4}=0,025.98=2,45\left(g\right)\end{matrix}\right.\)
c) \(n_{Na}=\dfrac{2,07}{23}=0,09\left(mol\right)\)
PTHH: 2Na + 2H2O --> 2NaOH + H2
0,09-------------->0,09
Xét tỉ lệ: \(\dfrac{0,09}{2}>\dfrac{0,04}{1}\) => NaOH dư, H2SO4 hết
2NaOH + H2SO4 --> Na2SO4 + 2H2O
0,08<-----0,04------>0,04
=> \(\left\{{}\begin{matrix}n_{NaOH\left(dư\right)}=0,01\left(mol\right)\\n_{Na_2SO_4}=0,04\left(mol\right)\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}m_{NaOH\left(dư\right)}=0,01.40=0,4\left(g\right)\\m_{Na_2SO_4}=0,04.142=5,68\left(g\right)\end{matrix}\right.\)
Đúng 2
Bình luận (0)
Hỗn hợp T gồm hai peptit mạch hở (được tạo thành từ alanin, glyxin, valin). Đốt cháy hoàn toàn m gam T, thu được
N
2
,
C
O
2
và 12,24 gam
H
2
O
. Thủy phân hoàn toàn m gam T trong 100 mL dung dịch gồm NaOH 1,6M và KOH 0,8M, thu được dung dịch Q chứa 26,76 gam chất tan. Để tác dụng vừa đủ với Q cần 220 mL dung dịch HCl 2M. Giá trị của m là A...
Đọc tiếp
Hỗn hợp T gồm hai peptit mạch hở (được tạo thành từ alanin, glyxin, valin). Đốt cháy hoàn toàn m gam T, thu được N 2 , C O 2 và 12,24 gam H 2 O . Thủy phân hoàn toàn m gam T trong 100 mL dung dịch gồm NaOH 1,6M và KOH 0,8M, thu được dung dịch Q chứa 26,76 gam chất tan. Để tác dụng vừa đủ với Q cần 220 mL dung dịch HCl 2M. Giá trị của m là
A. 12,06.
B. 16,96.
C. 15,64.
D. 19,22.
Chọn đáp án B
Cách 1: Biến đổi peptit – quy về đipeptit giải đốt cháy kết hợp thủy phân
có ∑ n c á c α – a m i n o a x i t = n H C l – ∑ n N a O H + n K O H = 0,2 mol.
• 0,1 mol T 2 + (0,16 mol NaOH + 0,08 mol KOH) → 26,76 gam c.tan + 0,1 mol H 2 O .
⇒ BTKL có m T 2 = 17,68 gam ⇒ có 0,1 mol T 2 dạng C n H 2 n N 2 O 3 nặng 17,68 gam
⇒ đốt 0,1 mol T 2 thu được n C O 2 = n H 2 O = (17,68 – 0,1 × 76) ÷ 14 = 0,72 mol.
mà đốt m gam T cho 0,68 mol H 2 O ⇒ cần thêm 0,04 mol H 2 O để chuyển T thành T 2
⇒ m = m T = m T 2 – m H 2 O thêm vào = 17,68 – 0,04 × 18 = 16,69 gam → chọn đáp án B. ♦.
Cách 2: tham khảo: tranduchoanghuy.
Quy m gam hỗn hợp T về C 2 H 3 N O , C H 2 v à H 2 O . Quy đổi quá trình thành:
m gam T + 0,16 mol NaOH + 0,08 mol KOH tác dụng vừa đủ 0,44 mol HCl.
⇒ n C 2 H 3 N O = 0,44 – 0,16 – 0,08 = 0,2 mol ⇒ n O H – d ư = 0,16 + 0,08 – 0,2 = 0,04 mol.
Q gồm H 2 N – C H 2 – C O O – , N a + , K + , O H – , C H 2 .
⇒ n C H 2 = (26,76 – 0,2 × 74 – 0,16 × 23 – 0,08 × 39 – 0,04 × 17) ÷ 14 = 0,32 mol.
n H 2 O = 0,68 – 0,2 × 1,5 – 0,32 = 0,06 mol ⇒ m = 0,2 × 57 + 0,32 × 14 + 0,06 × 18 = 16,96 gam.
Đúng 0
Bình luận (0)
Cho 4,15 gam hỗn hợp Fe, Al phản ứng với 200 ml dung dịch 0,525M. khuấy kỹ hỗn hợp để phản ứng xảy ra hoàn toàn. Đem lọc kết tủa (A) gồm hai kim loại nặng 7,84 gam và dung dịch nước lọc B. Để hòa tan kết tủa A cần ít nhất bao nhiêu lit dung dịch 2M biết phản ứng tạo ra NO. A. 0,12l B. 0,15 l C. 0,18l D. 0,2l
Đọc tiếp
Cho 4,15 gam hỗn hợp Fe, Al phản ứng với 200 ml dung dịch 0,525M. khuấy kỹ hỗn hợp để phản ứng xảy ra hoàn toàn. Đem lọc kết tủa (A) gồm hai kim loại nặng 7,84 gam và dung dịch nước lọc B. Để hòa tan kết tủa A cần ít nhất bao nhiêu lit dung dịch 2M biết phản ứng tạo ra NO.
A. 0,12l
B. 0,15 l
C. 0,18l
D. 0,2l
Đáp án C
Phản ứng xảy ra với Al trước, sau đó đến Fe. Theo giả thiết, kim loại sinh ra là Cu (kim loại hóa trị II).
Gọi x là số mol Al, y là số mol Fe phản ứng và z là số mol Fe dư:
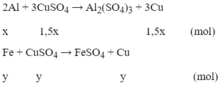
Ta có:
27x + 56(y + z) = 4,15 (1)
3x/2 + y = 0,280.525 = 0,105 (mol) (2)
64(1,5x + y) + 56y = 7,84 (3)
Phản ứng:
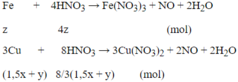
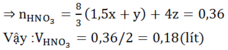
Đúng 1
Bình luận (1)
Hoà tan hoàn toàn 0,56 gam sắt bằng dung dịch
H
2
SO
4
loãng 19,6% vừa đủ. Cần bao nhiêu gam dung dịch
H
2
SO
4
loãng nói trên để hoà tan sắt?
Đọc tiếp
Hoà tan hoàn toàn 0,56 gam sắt bằng dung dịch H 2 SO 4 loãng 19,6% vừa đủ. Cần bao nhiêu gam dung dịch H 2 SO 4 loãng nói trên để hoà tan sắt?
Khối lượng H 2 SO 4 cần dùng :
m H 2 SO 4 = 0,01.98 = 0,98g
⇒ m dd H 2 SO 4 = 0,98 : 19,8% = 4,95g
Đúng 0
Bình luận (0)
Hòa tan hoàn toàn 2,24 gam sắt bằng dung dịch axit clohiđric 5%
a) Viết PTPƯ xảy ra?
b) Tính khối lượng muối tạo thành và tính thể tích khí thoát ra ở đktc
c) Tính khối lượng của dung dịch HCl 5% cần dùng để hòa tan hoàn toàn 2,24 gam sắt.
Ta có: \(n_{Fe}=\dfrac{2,24}{56}=0,04\left(mol\right)\)
a. PTHH: Fe + 2HCl ---> FeCl2 + H2
b. Theo PT: \(n_{FeCl_2}=n_{H_2}=n_{Fe}=0,04\left(mol\right)\)
=> \(m_{FeCl_2}=0,04.127=5,08\left(g\right)\)
=> \(V_{H_2}=0,04.22,4=0,896\left(lít\right)\)
c. Theo PT: \(n_{HCl}=2.n_{Fe}=2.0,04=0,08\left(mol\right)\)
=> \(m_{HCl}=0,08.36,5=2,92\left(g\right)\)
Ta có: \(C_{\%_{HCl}}=\dfrac{2,92}{m_{dd_{HCl}}}.100\%=5\%\)
=> \(m_{dd_{HCl}}=58,4\left(g\right)\)
Đúng 0
Bình luận (0)
hòa tan hoàn toàn 0,56g sắt bằng dung dịch H2SO4 loãng 19,6% vừa đủ
a, viết PTHH
b, tính khối lượng muối tạo thành và thể tích khí hidro sinh ra (đktc)
c, cần bao nhiêu gam dung dịch H2SO4 loãng nói trên để hòa tan sắt ?
giúp mình vớiiii
a, \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
Ta có: \(n_{Fe}=\dfrac{0,56}{56}=0,01\left(mol\right)\)
Theo PT: \(n_{H_2SO_4}=n_{FeSO_4}=n_{H_2}=n_{Fe}=0,01\left(mol\right)\)
b, \(m_{FeSO_4}=0,01.152=1,52\left(g\right)\)
\(V_{H_2}=0,01.22,4=0,224\left(l\right)\)
c, \(m_{ddH_2SO_4}=\dfrac{0,01.98}{19,6\%}=5\left(g\right)\)
Đúng 2
Bình luận (0)


















