Trong phòng thí nghiệm ,người ta dùng hiđro để khử sắt(III)oxit(Fe2O3) thu được 24 gam sắt. a. Viết phương trình hóa học của phản ứng xảy ra b.tính số gam sắt(III)oxit đã phản ứng c. tính thể tích khí hiđro dùng để khử(ở đktc)

Những câu hỏi liên quan
Trong phòng thí nghiệm, người ta dùng hiđro để khử sắt(III) oxit và thu được 11,2 gam sắt.
Viết phản ứng hóa học xảy ra.
Tính khối lượng sắt(III) oxit đã phản ứng.
Tính thể tích khí hiđro đã tiêu thụ (đktc).
:Trong phòng thí nghiệm người ta dùng khí hiđro để khử sắt(III) oxit và thu được 11,2 gam Fe. a) Viết phương trình hóa học của phản ứng đã xảy ra.
b) Tính khối lượng sắt(III) oxit đã phản ứng.
c) Tính thể tích khí hiđro đã tiêu thụ (ở đktc).
a, \(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
b, \(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
Theo PT: \(n_{Fe_2O_3}=\dfrac{1}{2}n_{Fe}=0,1\left(mol\right)\Rightarrow m_{Fe_2O_3}=0,1.160=16\left(g\right)\)
c, Theo PT: \(n_{H_2}=\dfrac{3}{2}n_{Fe}=0,3\left(mol\right)\)
\(\Rightarrow V_{H_2}=0,3.22,4=6,72\left(l\right)\)
Đúng 1
Bình luận (0)
Trong phòng thí nghiệm, người ta dùng hidro để khử sắt (III) oxit và thu được 11,2 gam sắt.
Viết phương trình hoá học của phản ứng đã xảy ra.
Tính khối lượng sắt(III) oxit đã phản ứng.
Tính thể tích khí hidro đã tiêu thụ (ở đktc).
Trong phòng thí nghiệm người ta dùng khí hiđro để khử sắt(II) oxit và thu được 11,2 g Fe.
a) Viết phương trình hóa học của phản ứng đã xảy ra.
b) Tính khối lượng sắt (III) oxit đã phản ứng.
c) Tính thể tích khí hiđro đã tiêu thụ (đktc).
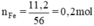
Phương trình hóa học của phản ứng:
Fe2O3 + 3H2 → 2Fe + 3H2O.
Khử 1 mol Fe2O3 cho 2 mol Fe.
x mol Fe2O3 → 0,2 mol.
x = 0,2 : 2 =0,1 mol.
m = 0,1 .160 =16g.
Khử 1 mol Fe2O3 cần 3 mol H2.
Vậy khử 0,1 mol Fe2O3 cần 0,3 mol H2.
V= 0,3 .22.4 = 6,72l.
Đúng 0
Bình luận (0)
trong phòng thí nghiệm người ta dùng khí H2 để khử sắt III oxit và thu đc 11.2 g sắt
a, viết phương trình hóa học của phản ứng xảy ra.
b, Tính khối lượng sắt III oxit đã phản ứng
c, tính thể tích khí H2 đã tiêu thụ ở dktc
nFe=0,2(mol)
a) PTHH: Fe2O3 + 3 H2 -to-> 2 Fe + 3 H2O
0,1_____________0,3____0,2(mol)
b) mFe2O3=160.0,1=16(g)
c) V(H2,đktc)=0,3.22,4=6,72(l)
Đúng 1
Bình luận (0)
nFe = 11.2/56 = 0.2 (mol)
FeO + H2 -to-> Fe + H2O
0.2.....0.2...........0.2
mFeO = 0.2*72 = 14.4 (g)
VH2 = 0.2*22.4 = 4.48 (l)
Đúng 0
Bình luận (2)
Trong phòng thí nghiệm người ta đã dùng cacbon oxit CO để khử 0,2 mol Fe3O4 và dùng khí hiđro để khử 0,2 mol Fe2O3 ở nhiệt đô cao. a) Viết phương trình hóa học của các phản ứng đã xảy ra. b) Tính số lít khí ở đktc CO và H2 cần dùng cho mỗi phản ứng. c) Tính số gam sắt thu được ở mỗi phản ứng hóa học.
Đọc tiếp
Trong phòng thí nghiệm người ta đã dùng cacbon oxit CO để khử 0,2 mol Fe3O4 và dùng khí hiđro để khử 0,2 mol Fe2O3 ở nhiệt đô cao.
a) Viết phương trình hóa học của các phản ứng đã xảy ra.
b) Tính số lít khí ở đktc CO và H2 cần dùng cho mỗi phản ứng.
c) Tính số gam sắt thu được ở mỗi phản ứng hóa học.
a) Phương trình hóa học của các phản ứng:
4CO + Fe3O4 → 3Fe + 4 CO2 (1).
3H2 + Fe2O3 → 2Fe + 3H2O (2).
b)Theo phương trình phản ứng trên ta có:
Muốn khử 1 mol Fe3O4 cần 4 mol CO.
Muốn khử 0,2 mol Fe3O4 cần x mol CO.
x= 0,2.4 = 0,8 mol CO.
VCO = 0,8 .22,4 = 17,92 lít.
Muốn khử 1 mol Fe2O3 cần 3 mol H2.
Muốn khử 0,2 mol Fe2O3 cần y mol H2.
y = 0,2 .3 = 0,6 mol.
VH2= 0,6 .22,4 = 13,44l.
c) Ở phản ứng (1) khử 1 mol Fe3O4 được 3 mol Fe.
Vậy khử 0,2 mol Fe3O4 được 0,6 mol Fe.
mFe = 0,6 .56 = 33,6g Fe.
Ở phản ứng (2) khử 1 mol Fe2O3 được 2 mol Fe.
Vậy khử 0,2 mol Fe2O3 được 0,4 mol Fe.
mFe = 0,4 .56 = 22,4g Fe.
Đúng 0
Bình luận (0)
Bài 2 : Trong phòng thí nghiệm, người ta dùng 6,72 lít khí hidro để khử sắt (III) oxit và thu được sắt và hơi nước .a) Viết phương trình hóa học của phản ứng đã xảy ra.b) Tính khối lượng sắt (III) oxit đã phản ứng.c) Tính khối lượng sắt tạo thành. Bài 3 : Trong phòng thí nghiệm, người ta điều chế 11,6g oxit sắt từ bằng cách oxi hóa sắt ở nhiệt độ cao.a) Viết phương trình hóa học xảy ra .b) Tính số gam sắt cần dùng .c) Tính thể tích khí oxi ở đktcd) Tính số gam Kali c...
Đọc tiếp
Bài 2 : Trong phòng thí nghiệm, người ta dùng 6,72 lít khí hidro để khử sắt (III) oxit và thu được sắt và hơi nước .
a) Viết phương trình hóa học của phản ứng đã xảy ra.
b) Tính khối lượng sắt (III) oxit đã phản ứng.
c) Tính khối lượng sắt tạo thành.
Bài 3 : Trong phòng thí nghiệm, người ta điều chế 11,6g oxit sắt từ bằng cách oxi hóa sắt ở nhiệt độ cao.
a) Viết phương trình hóa học xảy ra .
b) Tính số gam sắt cần dùng .
c) Tính thể tích khí oxi ở đktc
d) Tính số gam Kali clorat cần dùng để điều chế được lượng oxi đã tham gia phản ứng trên.
Fe = 56 , O =16 , K= 39 , Cl =35,5
2)
nH2 = 6.72/22.4 = 0.3 (mol)
Fe2O3 + 3H2 -to-> 2Fe + 3H2O
0.1______0.3______0.2
mFe2O3 = 0.1*160 = 16 (g)
mFe = 0.2*56 = 11.2 (g)
3)
nFe3O4 = 11.6/232 = 0.05 (mol)
3Fe + 2O2 -to-> Fe3O4
0.15___0.1______0.05
mFe = 0.15*56 = 8.4 (g)
VO2 = 0.1*22.4 = 2.24 (l)
2KClO3 -to-> 2KCl + 3O2
1/15______________0.1
mKClO3 = 1/15 * 122.5 = 8.167 (g)
Đúng 1
Bình luận (0)
a)
3H2 + Fe2O3 --to--> 2Fe + 3H2O
b) nH2 = 6,72/22,4 = 0,3 mol
Từ pt => nFe3O4 = 0,1 mol
=> mFe3O4 = 0,1. 232 = 23,2 g
Đúng 0
Bình luận (0)
1.
a) 3H2 + Fe2O3 --to--> 2Fe + 3H2O
b) nH2 = 6,72/22,4 = 0,3 mol
Từ pt => nFe3O4 = 0,1 mol
=> mFe3O4 = 0,1. 232 = 23,2 g
c) nFe = 0,2 mol
=> mFe = 0,2 . 56 = 11,2 (g)
Đúng 0
Bình luận (0)
trong phòng thí nghiệm, ngta dùng khí Hidro(H2) để khử sắt (III) oxit (Fe2O3) và thu đc 22,4 g sắt a) Viết PTHH xảy rab) tính khối lượng sắt (III) oxit đã phản ứng? c) tính thể tích khí hiđro đã tiêu dùng cho PƯ trên(ở đktc)d) để dốt cháy hoàn toàn lượng khí hiđro dùng chơ PƯ trên cần dungfbao nhiêu lít không khí(ở đktc).Biết khí õi chiếm 20%thể tích kkgiúp mik vs mik đag cần gấp mik c.ơn trước
Đọc tiếp
trong phòng thí nghiệm, ngta dùng khí Hidro(H2) để khử sắt (III) oxit (Fe2O3) và thu đc 22,4 g sắt
a) Viết PTHH xảy ra
b) tính khối lượng sắt (III) oxit đã phản ứng?
c) tính thể tích khí hiđro đã tiêu dùng cho PƯ trên(ở đktc)
d) để dốt cháy hoàn toàn lượng khí hiđro dùng chơ PƯ trên cần dungfbao nhiêu lít không khí(ở đktc).Biết khí õi chiếm 20%thể tích kk
giúp mik vs mik đag cần gấp ![]()
![]() mik c.ơn trước
mik c.ơn trước
a, \(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
b, \(n_{Fe}=\dfrac{22,4}{56}=0,4\left(mol\right)\)
Theo PT: \(n_{Fe_2O_3}=\dfrac{1}{2}n_{Fe}=0,2\left(mol\right)\Rightarrow m_{Fe_2O_3}=0,2.160=32\left(g\right)\)
c, \(n_{H_2}=\dfrac{3}{2}n_{Fe}=0,6\left(mol\right)\Rightarrow V_{H_2}=0,6.22,4=13,44\left(l\right)\)
d, \(2H_2+O_2\underrightarrow{t^o}2H_2O\)
Theo PT: \(n_{O_2}=\dfrac{1}{2}n_{H_2}=0,3\left(mol\right)\Rightarrow V_{O_2}=0,3.22,4=6,72\left(l\right)\)
\(\Rightarrow V_{kk}=\dfrac{V_{O_2}}{20\%}=33,6\left(l\right)\)
Đúng 3
Bình luận (1)
a)
$Fe_2O_3 + 3H_2 \xrightarrow{t^o} 2Fe + 3H_2O$
b) $n_{Fe} = \dfrac{22,4}{56} = 0,4(mol)$
Theo PTHH : $n_{Fe_2O_3} = \dfrac{1}{2}n_{Fe} = 0,2(mol)$
$m_{Fe_2O_3} = 0,2.160 = 32(gam)$
c) $n_{H_2} = \dfrac{3}{2}n_{Fe} = 0,6(mol)$
$V_{H_2} = 0,6.22,4 = 13,44(lít)$
d) $2H_2 + O_2 \xrightarrow{t^o} 2H_2O$
$V_{O_2} = \dfrac{1}{2}V_{H_2} = 6,72(lít)$
$V_{kk} = 6,72 : 20\% = 33,6(lít)$
Đúng 2
Bình luận (1)
Trong phòng thí nghiệm, người ta dùng khí hidro (H2) để khử 40 gam sắt (III) Oxit (F*e_{2}*O_{3}) a/ Viết phương trình hóa học xãy ra? b/ Tinh khối lượng sắt thu được? c/ Nếu người ta dùng 0.3 mol khí hidro để khử , thì sau phản ứng chất Cho biết : Fe = 56 O = 16, H = 1 nào dư?
a. \(PTHH:3H_2+Fe_2O_3\rightarrow2Fe+3H_2O\)
b. \(n_{Fe_2O_3}=\dfrac{m_{Fe_2O_3}}{M_{Fe_2O_3}}=\dfrac{40}{160}=0,25\left(mol\right)\)
- Mol theo PTHH : \(3:1:2:3\)
- Mol theo phản ứng : \(0,75\leftarrow0,25\rightarrow0,5\rightarrow0,75\)
\(\Rightarrow n_{Fe}=0,5\left(mol\right)\)
\(\Rightarrow m_{Fe}=n_{Fe}.M_{Fe}=0,5.56=28\left(g\right)\)
c. Ta có : \(n_{Fe_2O_3}=0,25\left(mol\right);n_{H_2}=0,3\left(mol\right)\)
Do \(0,25< 0,3\) ⇒ H2 dư.
Đúng 1
Bình luận (0)




















