Cho kim loại Zn, Fe........tác dụng với nước (H2O) Giúp mik vs ạ .mik cần gấp. C.ơn ạ

Những câu hỏi liên quan
6. cho 60,5g hỗn hợp kim loại Zn và Fe ( trong đó Fe chiếm 67,77 %) tác dụng vs dung dịch axit clohiđric.
a. viết các pt pư b. thể tích khí H2 tạo ra ( ở đktc)
------------------giải chi tiết giúp mik vs ạ----------------------
\(a.Zn+2HCl\rightarrow ZnCl_2+H_2\\ Fe+2HCl\rightarrow FeCl_2+H_2\\ b.m_{Fe}=60,5.66,77\%=41g\\ \Rightarrow n_{Fe}=\dfrac{41}{56}=0,73\left(mol\right)\\ n_{Zn}=\dfrac{60,5-41}{65}=0,3\left(mol\right)\\ \Sigma n_{H_2}=n_{Fe}+n_{Zn}=0,73+0,3=1,03\left(mol\right)\\ V_{H_2}=1,03.22,4=23,072\left(l\right)\)
Đúng 1
Bình luận (0)
a, PT: \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
b, Ta có: \(m_{Fe}=60,5.67,77\%=41\left(g\right)\Rightarrow n_{Fe}=\dfrac{41}{56}\left(mol\right)\)
\(m_{Zn}=60,5-41=19,5\left(g\right)\Rightarrow n_{Zn}=\dfrac{19,5}{65}=0,3\left(mol\right)\)
Theo PT: \(n_{H_2}=n_{Zn}+n_{Fe}=\dfrac{289}{280}\left(mol\right)\)
\(\Rightarrow V_{H_2}=\dfrac{289}{280}.22,4=23,12\left(l\right)\)
Đúng 0
Bình luận (0)
GIÚP MIK VỚI Ạ!! MIK ĐANG CẦN GẤP!
cho 14,7g hỗn hợp Na và k tác dụng hoàn toàn với nước sau phản ứng cho thấy thoát ra 5,6 lít H2. Tính khối lượng mỗi kim loại trong hỗn hợp ban đầu?
\(n_{H_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
PTHH: \(2Na+2H_2O\rightarrow2NaOH+H_2\)
\(2K+H_2O\rightarrow2KOH+H_2\)
Gọi số mol của \(Na\) là : a
Gọi số mol của \(K\) là : b
Ta có:
\(\left\{{}\begin{matrix}23a+39b=14,7\\0,5\left(a+b\right)=0,25\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}a=0,3\\b=0,2\end{matrix}\right.\)
\(m_{Na}=23.0,3=6,9\left(g\right)\)
\(m_K=39.0,2=7,8\left(g\right)\)
Đúng 3
Bình luận (0)
giúp mik vs ạ, mik đang cần gấp ạ, c.ơn mn ạ3
Đọc tiếp
giúp mik vs ạ, mik đang cần gấp ạ, c.ơn mn ạ<3
a. f(\(\dfrac{-1}{2}\)) = \(4.\left(\dfrac{-1}{2}\right)^2+3.\left(\dfrac{-1}{2}\right)-2\)
= \(4.\dfrac{1}{4}-\left(\dfrac{-3}{2}\right)-\dfrac{4}{2}\)
= \(\dfrac{2}{2}+\dfrac{3}{2}-\dfrac{4}{2}\)
= \(\dfrac{1}{2}\)
Đúng 1
Bình luận (0)
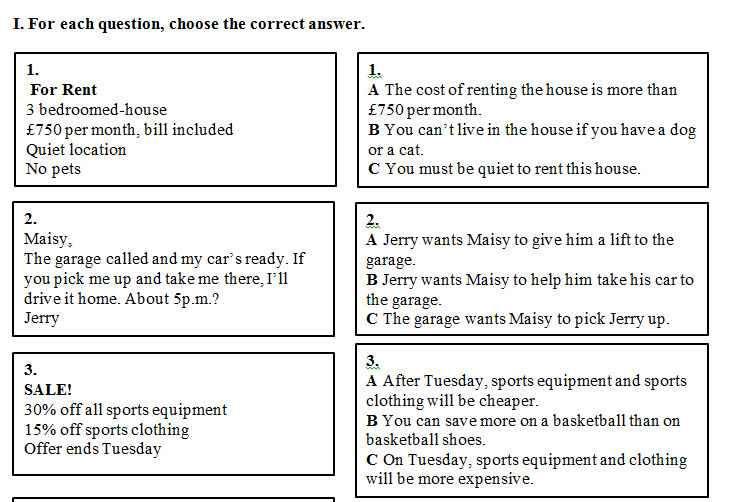

MN GIÚP MIK VS Ạ MIK CẦN GẤP. MIK C.ƠN
Trong PTN có các kim loại Mg và Zn, dung dịch axit clohiđric (HCl)a) Viết các PTPƯ có thể điều chế khí Hiđrob) Nếu cho cùng khối lượng các kim loại trên td vs axit dư thì kim loại nào cho nhiều khí Hiđro hơnGiups mik vs mik đag cần gấp mik c.ơn trước
Đọc tiếp
Trong PTN có các kim loại Mg và Zn, dung dịch axit clohiđric (HCl)
a) Viết các PTPƯ có thể điều chế khí Hiđro
b) Nếu cho cùng khối lượng các kim loại trên td vs axit dư thì kim loại nào cho nhiều khí Hiđro hơn
Giups mik vs mik đag cần gấp![]()
![]() mik c.ơn trước
mik c.ơn trước
a, PT: \(Mg+2HCl\rightarrow MgCl_2+H_2\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
b, Coi mMg = mZn = 1 (g)
Ta có: \(n_{H_2\left(Mg\right)}=n_{Mg}=\dfrac{1}{24}\left(mol\right)\)
\(n_{H_2\left(Zn\right)}=n_{Zn}=\dfrac{1}{65}\left(mol\right)\)
\(\Rightarrow\dfrac{1}{24}>\dfrac{1}{65}\)
Vậy: Mg cho nhiều khí H2 hơn.
Đúng 2
Bình luận (1)
cho 6.05g hỗn hợp kim loại Fe Zn tác dụng với dd H2SO4 đặc nóng thu được 2.8 lít khí SO2(đktc). xác định % khối lượng mỗi kim loại trong hỗn hợp. mọi ng giúp em giải câu này với ạ
gọi x và y lần lượt là số mol của Fe và Zn ( x không âm)
\(2Fe+6H_2SO_{4\left(đ,n\right)}\rightarrow Fe_2\left(SO_4\right)_3+3SO_2+6H_2O\)
x-------> 3x------------> 0,5x------------>1,5x------>3x
\(Zn+2H_2SO_{4\left(đ,n\right)}\rightarrow ZnSO_4+SO_2+2H_2O\)
y------->2y---------------->y-------->y------>2y
\(nSO_2=\dfrac{2,8}{22,4}=0,125\left(mol\right)\)
\(\left\{{}\begin{matrix}56x+65y=6,05\\1,5x+y=0,125\end{matrix}\right.\)
=> x = 0,05 ; y = 0,05
=> \(m_{Fe}=0,05.56=2,8\left(g\right)\)
=> \(\%m_{Fe}=\dfrac{2,8.100}{6,05}=46,28\%\)
=> \(\%m_{Zn}=100\%-46,28\%=53,72\%\)
Đúng 5
Bình luận (1)
Cho 6,5g kẽm tác dụng axit sunfuric theo phương trình sau: Zn+H2SO4→ZnSO4+H2a) Tính khối lượng H2SO4cần dùngb) Tính thể tích khí Hiđro thu được (ở đk thường)c) Tính khối lượng ZnSO4 thu được Giúp em vs ạ em đang cần lời giải gấp em c.ơn trước
Đọc tiếp
Cho 6,5g kẽm tác dụng axit sunfuric theo phương trình sau:
Zn+H2SO4→ZnSO4+H2
a) Tính khối lượng H2SO4cần dùng
b) Tính thể tích khí Hiđro thu được (ở đk thường)
c) Tính khối lượng ZnSO4 thu được
Giúp em vs ạ em đang cần lời giải gấp ![]()
![]() em c.ơn trước
em c.ơn trước
`n_Zn = m/M = 6,5/65 = 0,1 (mol) `
\(PTHH:Zn+H_2SO_4->ZnSO_4+H_2\)
Tỉ lệ: 1 : 1 : 1 : 1
n(mol) 0,1---->0,1-------------->0,1--->0,1
\(m_{H_2SO_4}=n\cdot M=0,1\cdot\left(2+32+16\cdot4\right)=9,8\left(g\right)\)
\(V_{H_2\left(dkt\right)}=n\cdot24=0,1\cdot24=2,4\left(l\right)\)
\(m_{ZnSO_4}=n\cdot M=0,1\cdot\left(65+32+16\cdot4\right)=16,1\left(g\right)\)
Đúng 1
Bình luận (2)
\(PTPU:Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
\(0,1:0,1:0,1:0,1\left(mol\right)\)
\(n_{Zn}=\dfrac{m}{M}=\dfrac{6,5}{65}=0,1\left(mol\right)\)
\(a,m_{H_2SO_4}=n.M=0,1.\left(2+32+16.4\right)=9,8\left(g\right)\)
\(b,V_{H_2}=n.22,4=0,1.22,4=2,24\left(l\right)\)
\(c,m_{ZnSO_4}=n.M=0,1.\left(65+32+16.4\right)=16,1\left(g\right)\)
Đúng 1
Bình luận (2)
Số mol Zn: \(n_{Zn}=\dfrac{m}{M}=\dfrac{6,5}{65}=0,1\left(mol\right)\)
Theo PTHH:
\(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
1 1 1 1 (mol)
0,1 0,1 0,1 0,1 (mol)
a) Khối lượng \(H_2SO_4\) cần dùng: \(m_{H_2SO_4}=n.M=0,1.98=9,8\left(g\right)\)
b) Thể tích khí hiđro thu được: \(V_{H_2}=n.24=0,1.24=2,4\left(l\right)\)
c) Khối lượng \(ZnSO_4\) thu được: \(m_{ZnSO_4}=n.M=0.1.161=16,1\left(g\right)\)
Đúng 0
Bình luận (0)
Xem thêm câu trả lời
Cho các kim loại : kẽm, nhôm lần lượt tác dụng với dung dịch axit sunfuric loãng.
a, Viết các phương trình phản ứng
b, Nếu thu được cùng một thể tích khí hidro thì khối lượng kim loại nào dùng cho phản ứng là nhỏ nhất ?
giúp mik vs ![]() mik đag cần gấp
mik đag cần gấp
\(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\uparrow\)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\uparrow\)
b) Nếu muốn thu được một lượng khí H2 bằng nhau thì cần số mol kim loại 2 PT bằng nhau . Ở PT 2 , 2 mol Al thu đc 3 mol H2 -> 1 mol Al thu được 1,5 khí H2
Vậy số g để Nhôm ở PT 2 pư thu đc 1 mol H2 là :
1,5.27=40,5(g)
Số g Zn để PT 2 pư thu đc 1 mol khí H2 là :
1.65=65(g)
=> Khối lượng kim loại Al dùng cho pư là nhỏ nhất
Đúng 1
Bình luận (1)
Hỗn hợp Al và Fe tác dụng với dung dịch chứa AgNO3 và Cu(NO3)2 thu được dung dịch B và chất rắn D gồm 3 kim loại. Cho D tác dụng với dung dịch HCl dư thấy có khí bay lên. Hỏi thành phần B và D. Viết phương trình phản ứng.
Mn giúp e vs ạ e đang cần gấp























