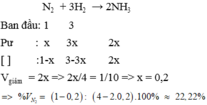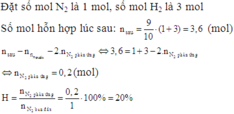Một hỗn hợp khí gồm N2 và H2 có thể tích bằng nhau đi qua thiết bị tiếp xúc thấy có 75% H2 phản ứng. Hãy tính % thể tích các khí trong hỗn hợp đi ra khỏi tháp tiếp xúc

Những câu hỏi liên quan
Đưa một hỗn hợp khí N2 và H2 có tỷ lệ 1: 3 vào tháp tổng hợp, sau phản ứng thấy thể tích khí đi ra giảm 1/10 so với ban đầu. Tính thành phần phần trăm về thể tích của hỗn hợp khí sau phản ứng A. 20%, 60%, 20% B. 22.22%, 66.67%, 11.11% C. 30%, 60%, 10% D. 33.33%, 50%, 16.67%
Đọc tiếp
Đưa một hỗn hợp khí N2 và H2 có tỷ lệ 1: 3 vào tháp tổng hợp, sau phản ứng thấy thể tích khí đi ra giảm 1/10 so với ban đầu. Tính thành phần phần trăm về thể tích của hỗn hợp khí sau phản ứng
A. 20%, 60%, 20%
B. 22.22%, 66.67%, 11.11%
C. 30%, 60%, 10%
D. 33.33%, 50%, 16.67%
Đưa một hỗn hợp khí N2 và H2 có tỉ lệ 1:3 vào tháp tổng hợp, sau phản ứng thấy thể tích khí đi ra giảm 1/10 so với ban đầu. Tính thành phần phần trăm về thể tích của hỗn hợp khí sau phản ứng: A. 20%; 60%; 20% B. 22,22%; 66,67%; 11,11% C. 30%; 60%; 10% D. 33,33%; 50%; 16,67%
Đọc tiếp
Đưa một hỗn hợp khí N2 và H2 có tỉ lệ 1:3 vào tháp tổng hợp, sau phản ứng thấy thể tích khí đi ra giảm 1/10 so với ban đầu. Tính thành phần phần trăm về thể tích của hỗn hợp khí sau phản ứng:
A. 20%; 60%; 20%
B. 22,22%; 66,67%; 11,11%
C. 30%; 60%; 10%
D. 33,33%; 50%; 16,67%
Đáp án B
Chọn thể tích ban đầu của N2 là 1 lít, H2 là 3 lít
→ Thể tích ban đầu là 4 lít
→Thể tích khí giảm là Vkhí giảm= 1/10.Vban đầu= 1/10.4= 0,4 lít
→VNH3 sinh ra= Vban đầu- Vsau= Vkhí giảm= 0,4 lít
N2+ 3H2![]() 2NH3
2NH3
VN2 pứ= 1/2VNH3 sỉnh = 0,2 lít,
VH2 pứ= 3/2.VNH3sinh= 0,6 lít
→VN2 dư= 0,8 lít, VH2 dư= 3-0,6= 2,4 lít
Tổng thể tích khí sau phản ứng là:
Vsau=9/10.Vban đầu= 0,9.4= 3,6 lít
→%VN2 dư= 0,8.100%/3,6=22,22%;
%VH2 dư= 2,4.100%/3,6=66,67%
%VNH3=11,11%
Đúng 0
Bình luận (0)
Hỗn hợp X gồm H2 và hai olefin đồng đẳng kế tiếp nhau. Cho 8,96 lít hỗn hợp X đi qua xúc tác Ni nung nóng thu được hỗn hợp Y. Dẫn Y qua dung dịch Br2 dư thấy khối lượng bình tăng 1,82 gam và thoát ra 5,6 lít hỗn hợp khí Z. Tỉ khối của Z đối với H2 là 7,72. Biết tốc độ phản ứng của hai olefin với hiđro là như nhau. Công thức phân tử và % thể tích thể tích của anken có ít nguyên tử hơn trong X là: A. C2H4, 20% B. C2H4,17,5% C. C3H6, 17,5% D. C3H6, 20%
Đọc tiếp
Hỗn hợp X gồm H2 và hai olefin đồng đẳng kế tiếp nhau. Cho 8,96 lít hỗn hợp X đi qua xúc tác Ni nung nóng thu được hỗn hợp Y. Dẫn Y qua dung dịch Br2 dư thấy khối lượng bình tăng 1,82 gam và thoát ra 5,6 lít hỗn hợp khí Z. Tỉ khối của Z đối với H2 là 7,72. Biết tốc độ phản ứng của hai olefin với hiđro là như nhau. Công thức phân tử và % thể tích thể tích của anken có ít nguyên tử hơn trong X là:
A. C2H4, 20%
B. C2H4,17,5%
C. C3H6, 17,5%
D. C3H6, 20%
Đáp án A
![]()
![]()
![]()
Áp dụng định luật bảo toàn khối lượng ta có:
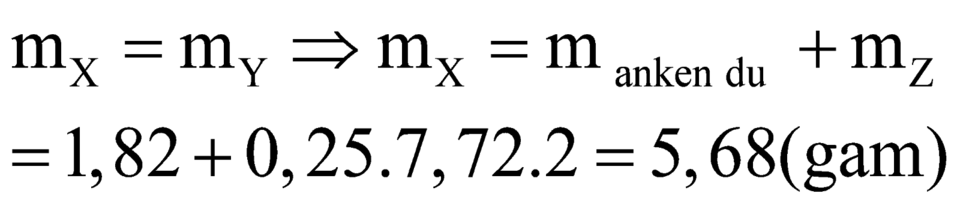
Mà ![]()
![]()
![]()
Do đó hai anken trong X là C2H4 và C3H6.
Cách 1: Áp dụng sơ đồ đường chéo hoặc giải hệ phương trình, ta có:
![]()
Cách 2: Ta có: ![]()
![]()
Vì ![]() nên
nên ![]()
Đúng 0
Bình luận (0)
Một hỗn hợp A gồm H2 và N2 có tỉ khối so với H2 lầ 3,6.Nung nóng hỗn hợp 1 thời gian với xúc tác thích hợp thu đc hỗn hợp khí B gồm N2,H2,NH3 có tỉ khối so với H2 là 4,5
a) Tính % thể tích hỗn hợp trước và sau phản ứng
b) tính hiệu suất của phản ứng
Hỗn hợp X gồm H2 và hai olefin là đồng đẳng kế tiếp nhau. Cho 8,96 lít hỗn hợp X đi qua xúc tác Ni nung nóng thu được hỗn hợp Y. Dẫn Y qua dung dịch Br2 dư thấy khối lượng bình tăng 1,82 gam và thoát ra 5,6 lít hỗn hợp khí Z. Tỉ khối của Z đối với H2 là 7,72. Biết tốc độ phản ứng của hai olefin với hiđro là như nhau. Công thức phân tử và % thể tích của anken có ít nguyên tử cacbon hơn trong X là A. C2H4; 20,0% B. C2H4; 17,5% C. C3H6; 17,5% D. C3H6; 20,0%
Đọc tiếp
Hỗn hợp X gồm H2 và hai olefin là đồng đẳng kế tiếp nhau. Cho 8,96 lít hỗn hợp X đi qua xúc tác Ni nung nóng thu được hỗn hợp Y. Dẫn Y qua dung dịch Br2 dư thấy khối lượng bình tăng 1,82 gam và thoát ra 5,6 lít hỗn hợp khí Z. Tỉ khối của Z đối với H2 là 7,72. Biết tốc độ phản ứng của hai olefin với hiđro là như nhau. Công thức phân tử và % thể tích của anken có ít nguyên tử cacbon hơn trong X là
A. C2H4; 20,0%
B. C2H4; 17,5%
C. C3H6; 17,5%
D. C3H6; 20,0%
Đáp án A
Vì nH2phản ứng = nanken phản ứng = nankan
→ nZ = nH2dư + nankan = nH2ban đầu = 0,25 mol.
→ nanken ban đầu = 0,4 - 0,25 = 0,15 mol.
Gọi x = nCnH2n + 2 → nH2dư = 0,25 - x (mol)
→ mZ = (14n + 2)x + 2(0,25 - x) = 0,25 x 7,72 x 2
→ 14nx = 3,36 (1)
nCnH2ndư = 0,15 - x → 14n(0,15 - x) = 1,82 (2)
Từ (1), (2) → x = 0,01; n = 2,47
→ C2H4 và C3H6.
• Đặt nC2H4 = a mol; nC3H6 = b mol.
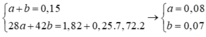
![]()
Đúng 0
Bình luận (0)
Đưa một hỗn hợp khí N2 và H2 có tỉ lệ 1:3 vào tháp tổng hợp, sau phản ứng thấy thể tích khí đi ra giảm 1/10 so với ban đầu. Hiệu suất của phản ứng tổng hợp NH3 là:
A. 10%
B. 20%
C. 15%
D. 25%
Trong một bình kín chứa 8 mol khí H2 và 3 mol khí N2 và một ít bột Ni làm xúc tác. Nung nóng bình trong một thời gian tới khi có 60% thể tích H2 phản ứng thì thu được hỗn hợp khí A (gồm N2, H2 và NH3).
a/ Tính thể tích NH3 tạo thành (đktc).
b/ Tính tỉ khối của A đối với H2.
a) \(N_2+3H_2-^{t^o}\rightarrow2NH_3\)
3..........8
Lập tỉ lệ \(\dfrac{3}{1}>\dfrac{8}{3}\) => Tính theo số mol H2
\(n_{H_2\left(pứ\right)}=8.60\%=4,8\left(mol\right)\)
=> \(n_{NH_3}=\dfrac{4,8.2}{3}=3,2\left(mol\right)\)
=> \(V_{NH_3}=3,2.22,4=71,68\left(l\right)\)
b) Hỗn hợp A gồm N2 dư, H2 dư, NH3
\(n_{N_2\left(dư\right)}=3-\dfrac{4,8}{3}=1,4\left(mol\right)\)
\(n_{H_2\left(dư\right)}=8-4,8=3,2\left(mol\right)\)
\(M_A=\dfrac{3,2.2+1,4.28+3,2.17}{3,2+1,4+3,2}=12,82\)
=>dA/H2 \(=\dfrac{12,82}{2}=6,41\)
Đúng 2
Bình luận (0)
Cho 5 lít khí N2 tác dụng với 5 lít khí H2 ở nhiệt độ cao, xúc tác thích hợp để tổng hợp khí NH3. Sau phản ứng thu được 7 lí hỗn hợp khí X gồm N2, H2, NH3. Tính thể tích mỗi khí trong hỗn hợp X thu được và hiệu suất phản ứng tổng hợp NH3. Biết các khí đo ở cùng điều kiện nhiệt độ và áp suất
N2 + 3H2 \(\overset{t^o,p,xt}{⇌}\) 2NH3.
Cứ 1 lít N2 tác dụng với 3 lít H2 tạo ra 2 lít NH3. Vậy a lít N2 tác dụng với 3a lít H2 tạo ra 2a lít NH3, thu được (5-a)+(5-3a)+2a=7 (lít), suy ra a=1,5 (lít).
Thể tích mỗi khí trong hỗn hợp X gồm khí N2 (5-1,5=3,5 (lít)), khí H2 (5-3.1,5=0,5 (lít)) và khí NH3 (2.1,5=3 (lít)).
Hiệu suất phản ứng là H=(5-0,5)/5.100%=90% (hiệu suất tính theo H2 do H2 thiếu).
Đúng 2
Bình luận (0)
Cho 8,96 lít (đktc) hỗn hợp khí gồm N2 và H2 có tỉ lệ thể tích 1:3.Đun nóng hỗn hợp trên với xúc tác thích hợp tạo ra NH3.Sau khi dừng phản ứng thu được &,84 lít hỗn hợp khí (đktc).Tính hiệu suất của phản ứng.
\(N_2+3H_2\leftrightarrow2NH_3\)
ban đầu: 1 mol 3 mol
phản ứng: a → 3a → 2a
dư: 1 – a 3 – 3a 2a
=> n hỗn hợp sau phản ứng = 1–a+3–3a+2a = 4 – 2a
n hỗn hợp trước phản ứng = 1 + 3 = 4 mol
Bảo toàn khối lượng:
m trước = m sau => Mt.n t = Ms.ns
\(\Rightarrow\dfrac{M_t}{M_s}=\dfrac{n_s}{n_t}\Rightarrow\dfrac{4-2a}{4}=0,6\\ \Rightarrow a=0,8\\ \Rightarrow H=\dfrac{0,8}{1}\cdot100\%=80\%\)
Đúng 1
Bình luận (0)
Cho hỗn hợp những thể tích bằng nhau của khí oxi và khí SO2 đi qua thiết bị tiếp xúc. Xác định thành phần % của hỗn hợp tạo thành, nếu khí SO2 bị oxi hóa 60%. Biết thể tích các khí đo ở cùng điều kiện nhiệt độ và áp suất
Coi \(n_{O_2} =n_{SO_2} = 1(mol)\)
\(n_{SO_2\ pư} = 1.60\% = 0,6(mol)\)
2SO2 + O2 \(\xrightarrow{t^o,xt}\) 2SO3
0,6...........0,3............0,6
Khí tạo thành gồm :
SO2 : 1-0,6 = 0,4(mol)
O2 : 1-0,3 =0,7(mol)
SO3 : 0,6(mol)
Vậy :
\(\%V_{SO_2} = \dfrac{0,4}{0,4 +0,7 + 0,6}.100\% = 23,53\%\\ \%V_{O_2} = \dfrac{0,7}{0,4 + 0,7 + 0,6}.100\% = 41,18\%\\ \%V_{SO_3} = 100\% -23,53\%-41,18\% = 35,29\%\)
Đúng 2
Bình luận (0)