ngâm 15g hỗn hợp Al,Mg,Ag cần vừa hết 600g H2SO4 9,8% thu được khí A , dd B và 2,4g chất rắn. tính m các chất trong hỗn hợp ban đầu

Những câu hỏi liên quan
1 Hòa tan hết 20g hỗn hợp Fe và FeO cần dùng vừa đủ 300g dd H2SO4 loãng , thu được dd X và 2,24l khí thoát ra ở đktc.Tính % khối lượng của sắt trong hõn hợp trên Tính C% của dd H2SO4 ban đầu và C%muối trong dd X2 Cho 8,4 gam bột sắt vào 100ml dd CuSO4 1M(D1,08g/ml) đến khi phản ứng kết thúc thu được chất rắn X và dd Y Viết PTHHTính a và C% chất tan có trong dd Y3Cho Ag hỗn hợp Fe,Cu có khối lượng bằng nhau vào dd H2SO4 loãng dư thu được 2,24 l khí (đktc), chất rắn ko tan đem hòa tan hết trong dd...
Đọc tiếp
1 Hòa tan hết 20g hỗn hợp Fe và FeO cần dùng vừa đủ 300g dd H2SO4 loãng , thu được dd X và 2,24l khí thoát ra ở đktc.Tính % khối lượng của sắt trong hõn hợp trên
Tính C% của dd H2SO4 ban đầu và C%muối trong dd X
2 Cho 8,4 gam bột sắt vào 100ml dd CuSO4 1M(D=1,08g/ml) đến khi phản ứng kết thúc thu được chất rắn X và dd Y
Viết PTHH
Tính a và C% chất tan có trong dd Y
3Cho Ag hỗn hợp Fe,Cu có khối lượng bằng nhau vào dd H2SO4 loãng dư thu được 2,24 l khí (đktc), chất rắn ko tan đem hòa tan hết trong dd H2SO4 đậm đặc nóng thu được Vlít SO2 (đktc). Ngâm Ag hỗn hợp trên vào dd CuSO4 dư.
Tính V
Tính khối lượng chất rắn thu được sau phản ứng
Khi cho 17,6 g hỗn hợp A gồm Mg và Cu tác dung vs m gam dd H2SO4 9,8% ( d=0,8 g/mol ) vừa đủ thấy xuất hiện 4,48 lít khí H2(đktc) và dd Y.
a) Tính K/L từng chất trog hỗn hợp ban đầu? Tính m?
b) Tính C% các chất trog dd sau pư? Tính CM các chất trog dd Y?
Cho m gam hỗn hợp gồm Al, Cu tác dụng với dd H2SO4 loãng dư, thu được 13, 44 lít khí (đktc) và chất rắn không tan. Đem đốt cháy chất rắn không tan thu được 24 gam chất bột màu đen.
a. Tính m.
b. Tính % khối lượng mỗi kim loại trong hỗn hợp ban đầu111
Đọc tiếp
Cho m gam hỗn hợp gồm Al, Cu tác dụng với dd H2SO4 loãng dư, thu được 13, 44 lít khí (đktc) và chất rắn không tan. Đem đốt cháy chất rắn không tan thu được 24 gam chất bột màu đen.
a. Tính m.
b. Tính % khối lượng mỗi kim loại trong hỗn hợp ban đầu111
B2: Cho hôn hợp gồm Mg và Al vào dd H2So4 thu đk 2,24 lít khí. Nếu hôn hợp trên cho vào H2So4 đặc nguội thì thu đk 0.56 lít khí A a, tính % khối lượng mõi kim loại trong hỗn hợp b, dẫn khí A vào 28g dd NaOH 15% . Tính C% các chất trong dung dịch sau phản ứng B3: Cho 14,2 hỗn hợp gồm Fe, Ag,Cu ttác dụng với dd Hcl dư thu đk 2,24lít khí và con lại chất rắn B.Cho B tác dụng hoàn toàn với dd H2So4 đặc nóng thu được 1,68lít khí a, tính % khối lượng mỗi kim loại trong hôn hợp b, tính V dd H2So4 98...
Đọc tiếp
B2: Cho hôn hợp gồm Mg và Al vào dd H2So4 thu đk 2,24 lít khí. Nếu hôn hợp trên cho vào H2So4 đặc nguội thì thu đk 0.56 lít khí A
a, tính % khối lượng mõi kim loại trong hỗn hợp
b, dẫn khí A vào 28g dd NaOH 15% . Tính C% các chất trong dung dịch sau phản ứng
B3: Cho 14,2 hỗn hợp gồm Fe, Ag,Cu ttác dụng với dd Hcl dư thu đk 2,24lít khí và con lại chất rắn B.Cho B tác dụng hoàn toàn với dd H2So4 đặc nóng thu được 1,68lít khí
a, tính % khối lượng mỗi kim loại trong hôn hợp
b, tính V dd H2So4 98% (D= 1,84 g/ml) cần thiết tan hết B
B4, Hòa tan 11g hôn hợp gồm NaBr và Nacl thành dd. Cho dd trên tác dụng vừa đủ với 127,5g dd AgNO3 20%
a, Tính khối lượng kết tủa tạo thành
b, tính C% các chất có trong dd thu được
BÀI 1: Cho 4,93g hỗn hợp A gồm Mg, Zn vào 250g ddHCl 7,3%a) Chưng minh hỗn hợp A tan hếtb) Tính m, %m mỗi kim loại trong A , biết rằng HCl còn lại trong dd thu được là 52% so với lượng ban đầuc) Tính C% chất tan trong dd thu đượcBÀI 2: Đốt cháy hỗn hợp CuO và FeO với C có dư thì được chất rắn A và khí B. Cho B tác dụng với dd Ca(OH)2 lấy dư thu được 8g CaCO3. Chất rắn A cho tác dụng vừa đủ với 250g dd HCl 2,92%a) tính m, %m mỗi oxit trong hỗn hợp ban đầub) tính V khí B (đktc)
Đọc tiếp
![]() BÀI 1: Cho 4,93g hỗn hợp A gồm Mg, Zn vào 250g ddHCl 7,3%
BÀI 1: Cho 4,93g hỗn hợp A gồm Mg, Zn vào 250g ddHCl 7,3%
a) Chưng minh hỗn hợp A tan hết
b) Tính m, %m mỗi kim loại trong A , biết rằng HCl còn lại trong dd thu được là 52% so với lượng ban đầu
c) Tính C% chất tan trong dd thu được
BÀI 2: Đốt cháy hỗn hợp CuO và FeO với C có dư thì được chất rắn A và khí B. Cho B tác dụng với dd Ca(OH)2 lấy dư thu được 8g CaCO3. Chất rắn A cho tác dụng vừa đủ với 250g dd HCl 2,92%
a) tính m, %m mỗi oxit trong hỗn hợp ban đầu
b) tính V khí B (đktc)
1> Mg+2HCl------>MgCl2+H2
Zn+2HCl----->ZnCl2+H2
mHCl=250.7,3/100=18,25 g
nHCl=18,25/36,50,5 mol
Giả sử 4,93 g hỗn hợp toàn là kim loại Mg
n tối đa =4,93/24=0,205 mol--->nHCl tối đa=0,205.2=0,41 mol
giả sử 4,93 g hỗn hợp toàn là Zn
n tối thiểu =4,93/65=0,076 mol----->nHCl tối thiểu=0,076.2=0,152 mol-
----->0,152<nHCltham gia phản ứng<0,41
mà nHcl=0,5 mol----->HCl dư-----> hỗn hợp tan hết
Đúng 0
Bình luận (2)
Cho 32g hỗn hợp gồm mg và mgo tác dụng vừa đủ hết với dd hcl 7.3% sau pứ người ta thu được 22.4 lít khí ở đktc. a) tính phần trăm khối lượng mỗi chất trong hỗn hợp ban đầu. b)tính khối lượng dd hcl cần dùng cho các pứ trên. C) tính nồng độ phần trăm của chất có trong dd sau khi pứ kết thúc.
Đốt cháy hoàn toàn 15,6 gam hỗn hợp gồm Mg và Ag trong không khí thu được 18,8 g hỗn hợp chất rắn.
a) viết PTHH xảy ra
b) tính thể tích không khí cần dùng ở đktc biết rằng thể tích oxi chiếm 20% thể tích không khí
c) tính thành phần phần trăm các kim loại trong hỗn hợp ban đầu
Xem chi tiết
a. Ag không phản ứng nên ta có PTHH: \(2Mg+O_2\rightarrow^{t^o}2MgO\)
\(\rightarrow m_{O_2}=m_{hh}-m_{\mu\text{ối}}=18,8-15,6=3,2g\)
\(\rightarrow n_{O_2}=\frac{3,2}{32}=0,1mol\)
b. \(\rightarrow V_{O_2}=n.22,4=22,4.0,1=2,24l\)
\(\rightarrow V_{kk}=4,48.5=11,2l\)
c. Có \(n_{Mg}=2n_{O_2}=0,2l\)
\(\rightarrow m_{Mg}=0,2.24=4,8g\)
\(\rightarrow\%m_{Mg}=\frac{4,8.100}{15,6}\approx30,77\%\)
\(\rightarrow\%m_{Ag}=100\%-30,77\%=69,23\%\)
Cho hỗn hợp X gồm AI và Mg tác dụng vừa đủ với 1,344 lít (đktc) hỗn hợp khí Y gồm
O
2
và
Cl
2
.
d
Y
/
H
2
27,375 . Sau phản ứng thu được 5,055 gam chất rắn. Tính khối lượng của Al và Mg trong hỗn hợp ban đầu...
Đọc tiếp
Cho hỗn hợp X gồm AI và Mg tác dụng vừa đủ với 1,344 lít (đktc) hỗn hợp khí Y gồm O 2 và Cl 2 . d Y / H 2 = 27,375 . Sau phản ứng thu được 5,055 gam chất rắn. Tính khối lượng của Al và Mg trong hỗn hợp ban đầu.
- Từ giả thiết tính được : n Cl 2 = 0,035 mol; n O 2 = 0,025 mol
Theo ĐLBT khối lượng :
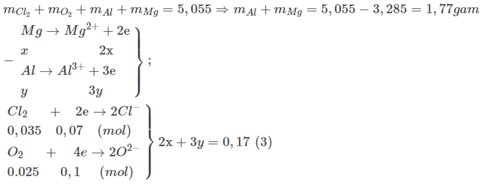
Từ (3)(4) ⇒ x = 0,04; y = 0,03
⇒ m Mg = 0,04.24 = 0,96g; m Al = 0,03.27 = 0,81g
Phản ứng không oxi hoá - khử
Đúng 0
Bình luận (0)
cho 14,8gam hỗn hợp Al và MgO vào dung dịch H2SO4 10% (vừa đủ) thì thu được 13,44 lít khí (đktc). a) Tính % theo khối lượng mỗi chất trong hỗn hợp ban đầu . b) Tính khối lượng dung dịch H2SO4 cần dùng? . c) Tính nồng độ % các muối có trong dung dịch thu được sau phản ứng?
a, PT: \(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
\(MgO+H_2SO_4\rightarrow MgSO_4+H_2O\)
Ta có: \(n_{H_2}=\dfrac{13,44}{22,4}=0,6\left(mol\right)\)
Theo PT: \(n_{Al}=\dfrac{2}{3}n_{H_2}=0,4\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Al}=\dfrac{0,4.27}{14,8}.100\%\approx72,97\%\\\%m_{MgO}\approx27,03\%\end{matrix}\right.\)
b, Ta có: \(n_{MgO}=\dfrac{14,8-0,4.27}{40}=0,1\left(mol\right)\)
Theo PT: \(n_{H_2SO_4}=n_{H_2}+n_{MgO}=0,7\left(mol\right)\)
\(\Rightarrow m_{H_2SO_4}=0,7.98=68,6\left(g\right)\)
\(\Rightarrow m_{ddH_2SO_4}=\dfrac{68,6}{10\%}=686\left(g\right)\)
c, Theo PT: \(\left\{{}\begin{matrix}n_{Al_2\left(SO_4\right)_3}=\dfrac{1}{2}n_{Al}=0,2\left(mol\right)\\n_{MgSO_4}=n_{MgO}=0,1\left(mol\right)\end{matrix}\right.\)
Ta có: m dd sau pư = 14,8 + 686 - 0,6.2 = 699,6 (g)
\(\Rightarrow\left\{{}\begin{matrix}C\%_{Al_2\left(SO_4\right)_3}=\dfrac{0,2.342}{699,6}.100\%\approx9,78\%\\C\%_{MgSO_4}=\dfrac{0,1.120}{699,6}.100\%\approx1,72\%\end{matrix}\right.\)
Đúng 2
Bình luận (0)


















