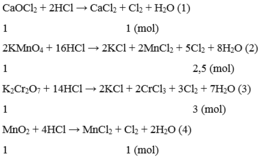Những câu hỏi liên quan
Nếu cho 1 mol mỗi chất: CaOCl2, KMnO4, K2Cr2O7, MnO2 lần lượt phản ứng với lượng dư dung dịch HCl đặc, chất tạo ra lượng chất Cl2 nhiều nhất là A. K2Cr2O7 B. MnO2 C. CaOCl2 D. KMnO4
Đọc tiếp
Nếu cho 1 mol mỗi chất: CaOCl2, KMnO4, K2Cr2O7, MnO2 lần lượt phản ứng với lượng dư dung dịch HCl đặc, chất tạo ra lượng chất Cl2 nhiều nhất là
A. K2Cr2O7
B. MnO2
C. CaOCl2
D. KMnO4
Đáp án A
Đáp án A do Cr nhường 6e (có 2 nguyên tử Cr), nhường nhiều e nhất nên tạo ra nhiều khí nhấ
Đúng 0
Bình luận (0)
Nếu cho 1 mol mỗi chất:
C
a
O
C
l
2
,
K
M
n
O
4
,
K
2
C
r
2
O
7
,
M
n
O
2
lần lượt phản ứng với lượng dư dung dịch HCl đặc, chất tạo ra lượng khí
C
l
2
nhiều nhất là A.
K...
Đọc tiếp
Nếu cho 1 mol mỗi chất: C a O C l 2 , K M n O 4 , K 2 C r 2 O 7 , M n O 2 lần lượt phản ứng với lượng dư dung dịch HCl đặc, chất tạo ra lượng khí C l 2 nhiều nhất là
A. K M n O 4
B. C a O C l 2
C. K 2 C r 2 O 7
D. M n O 2
Nếu cho 1 mol mỗi chất:
C
a
O
C
l
2
,
K
M
n
O
4
,
K
2
C
r
2
O
7
,
M
n
O
2
lần lượt phản ứng với lượng dư dung dịch HCl đặc, chất tạo ra lượng khí...
Đọc tiếp
Nếu cho 1 mol mỗi chất: C a O C l 2 , K M n O 4 , K 2 C r 2 O 7 , M n O 2 lần lượt phản ứng với lượng dư dung dịch HCl đặc, chất tạo ra lượng khí C l 2 nhiều nhất là
A. C a O C l 2
B. K M n O 4
C. K 2 C r 2 O 7
D. M n O 2
Chọn đáp án C
C a O C l 2 + 2HCl → C a C l 2 + C l 2 + H 2 O
1 1 mol
2 K M n O 4 + 16HCl → 2KCl + 2 M n C l 2 + 5 C l 2 + 8 H 2 O
1 2,5 mol
K 2 C r 2 O 7 + 14HCl → 2KCl + 2 C r C l 3 + 3 C l 2 + 7 H 2 O
1 3 mol
M n O 2 + 4HCl → M n C l 2 + C l 2 + 2 H 2 O
1 1 mol
Vậy nếu cho cùng 1 mol mỗi chất C a O C l 2 , K M n O 4 , K 2 C r 2 O 7 , MnO2 thì K 2 C r 2 O 7 cho lượng khí C l 2 nhiều nhất.
Đúng 0
Bình luận (0)
Để điều chế khí oxi người ta phân hủy KMnO4 và KCLO3 a/Để thu được lượng khí oxi như nhau,chất nào cần số mol nhiều hơn?Cần dùng khối lượng nhiều hơn? b/phân hủy cùng số mol,chất nào sinh ra khí nhiều hơn? c/phân hủy cùng khối lượng chất nào sinh ra khí oxi nhiều hơn? d/Biết giá thành 1kg KMnO4 là 200000đ,1kg KCLO3 là 300000đ,hãy cho biết để điều chế khí oxi như nhau,thì dùng chất nào có giá thành rẻ nhiều hơn?
Đọc tiếp
Để điều chế khí oxi người ta phân hủy KMnO4 và KCLO3
a/Để thu được lượng khí oxi như nhau,chất nào cần số mol nhiều hơn?Cần dùng khối lượng nhiều hơn?
b/phân hủy cùng số mol,chất nào sinh ra khí nhiều hơn?
c/phân hủy cùng khối lượng chất nào sinh ra khí oxi nhiều hơn?
d/Biết giá thành 1kg KMnO4 là 200000đ,1kg KCLO3 là 300000đ,hãy cho biết để điều chế khí oxi như nhau,thì dùng chất nào có giá thành rẻ nhiều hơn?
a)6KMnO4--->3K2MnO4 + 3MnO2 + 3O2 (1)
2KClO3---> 2KCl + 3O2 (2)
Dựa vào phương trình trên ---> thu cùng lượng O2, KMnO4 cần nhiều số mol hơn, và khối lượng nhiều hơn.
b)6KClO3-->6KCl + 9O2 (3)
1,3--->Cùng số mol, KClO3 cho nhiều O2 hơn.
c)Giả sử cả 2 chất cùng có khối lượng là 100g
nKMnO4=50/79(mol)
nKClO3=40/49
Thay vào các phương trình phản ứng tính ra mO2
Cụ thể: KMnO4 cho ra 800/79 (g) O2
KClO3 cho ra 1920/49 (g) O2
---> Cùng m thì KClO3 cho nhiều g O2 hơn.
d) Giả sử cần điều chế 32 g O2
--->nO2=1 mol
--->nKMnO4=2 mol--->mKMnO4=316g
và nKClO3=2/3 mol--->nKClO3=245/3g
Ta có:
-1000g KMnO4 <=> 200000đ
316 g=========>63200đ
-1000g KClO3 <=> 300000đ
245/3g========> 24500đ
Vậy để điều chế cùng lượng O2, KClO3 có giá thành rẻ hơn.
Đúng 0
Bình luận (0)
Cho các chất KMnO4 ; MnO2; HCl
a/ Nếu khối lượng các chất KMnO4 và MnO2 bằng nhau chọn chất nào để có thể điều chế được khí clo nhiều nhất
b/ Mết số mol của KMnO4 và MnO2 bằng nhau, thì chọn chất nào để điều chế được khí clo nhiều nhất
c/ Nếu muốn điều chế 1 thể tích clo nhất định thì chon KMnO4 hay MnO2 để tiết kiệm HCl
a) - Nếu dùng KMnO4:
2 KMNO4 + 16 HCl = 2 KCl + 2 MnCl2 + 8 H2O + 5 Cl2 (1)
- Nếu dùng MnO2:
MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O (2)
Theo pt ta thấy (1) tạo ra 5Cl2 còn pư (2) chỉ tạo 1Cl2, chứng tỏ (1) tạo ra nhiều clo hơn (2).
b) giả sử số mol của KMnO4 và MnO2 là 0.2 mol
2 KMNO4 + 16 HCl = 2 KCl + 2 MnCl2 + 8 H2O + 5 Cl2 (1)
0.2.................................................................................0.5
MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O (2)
0.2........................................0.2
Ta thấy số mol Cl2 ở (1) lớn hơn số mol Cl2 ở (2), suy ra pư (1) tạo nhiều clo hơn (2).
c) Từ (1) và (2) ta thấy:
Số mol HCl (1) lớn gấp 4 lần số mol HCl ở (2), suy ra ở pư (1) tiêu tốn HCl hơn pư (2).
Để thu được nhiều Clo hơn ta nên dùng pư (1) , còn muốn tiết kiệm HCl ta nên dùng MnO2.
Đúng 0
Bình luận (0)
Nếu lấy cùng một lượng (số mol) KClO3 và KMnO4 để điều chế khí oxygen thì chất nào sẽ cho nhiều khí oxygen hơn?
Giả sử ta lấy cùng một khối lượng là a gam
\(n_{KClO_3}=\dfrac{m_{KClO_3}}{M_{KClO_3}}=\dfrac{a}{122,5}\left(mol\right)\)
\(n_{KMnO_4}=\dfrac{m_{KMnO_4}}{M_{KMnO_4}}=\dfrac{a}{158}\left(mol\right)\)
\(2KClO_3\xrightarrow[]{t^o}2KCl+3O_2\) (1)
Theo phương trình:
\(n_{O_2\left(1\right)}=\dfrac{3}{2}n_{KClO_3}=\dfrac{3}{2}.\dfrac{a}{122,5}=\dfrac{3a}{245}\)
\(2KMnO_4\xrightarrow[]{t^2}K_2MnO_4+MnO_2+O_2\) (2)
Theo phương trình:
\(n_{O_2\left(2\right)}=\dfrac{1}{2}n_{KMnO_4}=\dfrac{1}{2}.\dfrac{a}{158}=\dfrac{a}{316}\left(mol\right)\)
Ta thấy: \(\dfrac{a}{316}< \dfrac{a}{245}\)
\(\Rightarrow n_{O_2\left(2\right)}< n_{O_2\left(2\right)}\)
Vậy khi nhiệt phân cùng 1 lượng chất cho nhiều oxi hơn là KClO3
Đúng 2
Bình luận (0)
\(PTHH:2KClO_3\underrightarrow{to}2KCL+3O_2\uparrow\)
\(2KMnO_4\underrightarrow{to}K_2MnO_4+MnO_2+O_2\uparrow\)
Từ PTHH trên ta thấy đc rằng:
\(KClO_3\) sẽ điều chế khí oxygen nhiều hơn do phân huỷ nhiều Oxygen
Đúng 0
Bình luận (0)
Nếu cho 1 mol mỗi chất: CaOCl2, KMnO4, K2Cr2O7, MnO2 lần lượt phản ứng với lượng dư dung dịch HCl đặc, chất tạo ra lượng khí nhiều nhất là A. KMnO4 B. K2Cr2O7 C. CaOCl2 D. MnO2
Đọc tiếp
Nếu cho 1 mol mỗi chất: CaOCl2, KMnO4, K2Cr2O7, MnO2 lần lượt phản ứng với lượng dư dung dịch HCl đặc, chất tạo ra lượng khí nhiều nhất là
A. KMnO4
B. K2Cr2O7
C. CaOCl2
D. MnO2
Trong phản ứng với HCl đặc thì chất nào nhận electron nhiều nhất thì cho lượng Cl2 lớn nhất.
Giả sử có 1 mol mỗi chất CaOCl2, KMnO4, K2Cr2O7, MnO2 lần lượt phản ứng với lượng dư dung dịch HCl đặc thì số mol electron nhận lần lượt là 2 mol, 5 mol, 6 mol, 2 mol.
Vậy chất tạo ra lượng khí Cl2 nhiều nhất là K2Cr2O7. Đáp án B.
Đúng 0
Bình luận (0)
a) Tính % oxi trong các chất sau: KMnO4, KCLO3, KNO3
b) So sánh số mol oxi điều chế được bằng sự phân huỷ số mol của mỗi chất trên
c) Phân huỷ cùng số mol của các chất trên có phải chất có hàm lượng oxi cao cho nhiều oxi
a) %O trong KMnO4=\(\frac{16.4}{40+24+16.4}.100=50\%\)
%O trong KClO3= \(\frac{16.3}{40+35,5+16.3}.100=38,9\%\)
%O trong KNO3=\(\frac{16.3}{40+14+16.3}.100=47,1\%\)
Đúng 1
Bình luận (2)
1) Cho 1 mol các chất (CaOCl2, KMnO4, K2Cr2O7, MnO2) tác dụng với HCl dư. Chất nào tạo ra lượng khí Clo nhiều nhất, ít nhất ?
2) Cho cùng 100g các chất (CaOCl2, KMnO4, K2Cr2O7, MnO2) tác dụng với HCl dư. Chất nào tạo ra lượng khí Clo nhiều nhất, ít nhất ?
(Mình đang cần gấp các bạn cố gắng giúp mình nhé. Trình bày theo dạng tự luận nha.)
1)
| CaOCl2 | + | 2HCl | → | Cl2 | + | H2O | + | CaCl2 |
| 16HCl | + | 2KMnO4 | → | 5Cl2 | + | 8H2O | + | 2KCl | + | 2MnCl2 |
| 14HCl | + | K2Cr2O7 | → | 3Cl2 | + | 7H2O | + | 2KCl | + | 2CrCl3 |
| 4HCl | + | MnO2 | → | Cl2 | + | 2H2O | + | MnCl2 |
Theo pt:
-1mol CaOCl2 sẽ tạo ra 1mol Cl2
-1mol KMnO4 sẽ tạo ra 2,5mol Cl2
-1mol K2Cr2O7 sẽ tạo ra 3mol Cl2
-1mol MnO2 sẽ tạo ra 1mol Cl2
Vậy K2Cr2O7 tạo ra lượng khí clo nhiều nhất,CaOCl2 và MnO2 tạo ra lượng khí clo ít nhất
Đúng 0
Bình luận (0)
Theo đề, ta có: \(n_{CaOCl_2}=\dfrac{100}{127}\left(mol\right)\\ n_{KMnO_4}=\dfrac{100}{158}=\dfrac{50}{79}\left(mol\right)\\ n_{K_2Cr_2O_7}=\dfrac{100}{294}=\dfrac{50}{147}\left(mol\right)\\ n_{MnO_2}=\dfrac{100}{87}\left(mol\right)\)|
\(CaOCl_2+2HCl\rightarrow Cl_2+H_2O+CaCl_2\)
\(16HCl+2KMnO_4\rightarrow5Cl_2+8H_2O+2KCl+2MnCl_2\)
\(14HCl+K_2Cr_2O_7\rightarrow3Cl_2+7H_2O+2KCl+2CrCl_3\)
\(4HCl+MnO_2\rightarrow MnCl_2+2H_2O\)
Theo phương trình:
- \(\dfrac{100}{127}mol\) CaOCl2 sẽ tạo ra \(\dfrac{100}{127}mol\) Cl2.
- \(\dfrac{100}{158}mol\) KMnO4 sẽ tạo ra \(\dfrac{125}{79}mol\) Cl2.
- \(\dfrac{100}{294}mol\) K2Cr2O7 sẽ tạo ra \(\dfrac{50}{49}mol\) Cl2.
- \(\dfrac{100}{87}mol\) MnO2 sẽ tạo ra \(\dfrac{100}{87}mol\) Cl2.
Vậy 100(g) KMnO4 sẽ tạo ra lượng Cl2 nhiều nhất, 100(g) CaOCl2 sẽ tạo ra lượng Cl2 ít nhất.
Đúng 0
Bình luận (0)