% về khối lượng của K trong K2SO4 là (Cho NTK K = 39, S = 32, O = 16)
Câu 19. Phân tử khối của KMnO4 là 158 đvC. Trong phân tử kali penmanganat có 1K, 1Mn và 4O. Tính nguyên tử khối Mn, biết NTK O là 16, NTK K là 39.
NTK Mn = \(158-39.1-4.16=55\left(đvC\right)\)
klpt : Fe2O3 là : 56.2+16.3=160(amu)
%Fe = \(\dfrac{56.2}{160}\) . 100% = 70%
%O = \(\dfrac{16.3}{160}\) . 100% = 305
Làm ơn tick cho mk
Nhiệt phân hoàn toàn 24,5 gam KClO3 thu được KCl và khí O2.
a) Tính thể tích khí O2 thu được (đkc).
b) Cho toàn bộ khí O2 trên tác dụng với 32 gam Cu.
- Sau phản ứng, chất nào còn dư? Dư bao nhiêu gam?
- Tính khối lượng CuO thu được. Cho NTK: K=39, O=16; Cu = 64, Cl = 35,5.
a, PT: \(2KClO_3\underrightarrow{t^o}2KCl+3O_2\)
Ta có: \(n_{KClO_3}=\dfrac{24,5}{122,5}=0,2\left(mol\right)\)
Theo PT: \(n_{O_2}=\dfrac{3}{2}n_{KClO_3}=0,3\left(mol\right)\)
\(\Rightarrow V_{O_2}=0,3.24,79=7,437\left(g\right)\)
b, PT: \(2Cu+O_2\underrightarrow{t^o}2CuO\)
Ta có: \(n_{Cu}=\dfrac{32}{64}=0,5\left(mol\right)\)
Xét tỉ lệ: \(\dfrac{0,5}{2}< \dfrac{0,3}{1}\), ta được O2 dư.
Theo PT: \(\left\{{}\begin{matrix}n_{O_2\left(pư\right)}=\dfrac{1}{2}n_{Cu}=0,25\left(mol\right)\\n_{CuO}=n_{Cu}=0,5\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow n_{O_2\left(dư\right)}=0,3-0,25=0,05\left(mol\right)\)
\(\Rightarrow m_{O_2\left(dư\right)}=0,05.32=1,6\left(g\right)\)
\(m_{CuO}=0,5.80=40\left(g\right)\)
Tính khối lượng phân tử của các chất sau:H2O,K2O,CaCO3,H2SO4,CO2(biết H=1,C=12,O=16,S=32,K=39,Ca=40
\(H_2O=1.2+16=18< amu>.\)
\(K_2O=39.2+16=94< amu>.\)
\(CaCO_3=40+12+16.3=100< amu>.\)
\(H_2SO_4=1.2+32+16.4=98< amu>.\)
\(CO_2=12+16.2=44< amu>.\)
Biết nguyên tử khối của A gấp 16 lần phân tử khối của khí Hidro, Kí hiệu hóa học của nguyên tố A là? (Biết NTK H=1, Na=23, Ca=40, K=39, O=16)
Nguyên tử khối trung bình của clo là 35,5. Thành phần % khối lượng của 37Cl trong KClO3 là (cho K = 39, O = 16)
A. 7,24%.
B. 7,55%.
C. 25,00%.
D. 28,98%.
Đáp án B
Giả sử % nguyên tử 35Cl và 37Cl trong tự nhiên lần lượt là x, y
Ta có hpt
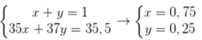
Phần trăm khối lượng của 37Cl trong KClO3 là
%= 0 , 25 . 37 39 + 35 , 5 + 16 . 3 ≈ 7 , 55 %
Trong tự nhiên, Clo có 2 đồng vị C 35 l và C 37 l , trong đó đồng vị chiếm C 35 l 75% về số đồng vị. Phần trăm khối lượng của C 35 l trong K C l O 4 là (cho nguyên tử khối: K=39, O=16)
A. 21,43%.
B. 7,55%.
C. 18,95%.
D. 64,29%.
ChọnC
Nguyên tử khối trung bình của Cl là :
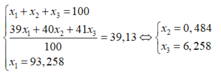
Giả sử có 1 mol K C l O 4 → Số mol Cl = 1; số mol C 35 l là 0,75.
Phần trăm khối lượng của C 35 l trong K C l O 4 là
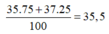
cho 200ml dung dịch BaCl2 0,5M tác dụng hết với V( lít ) dung dịch K2SO4 1M sau phản ứng thu được chất kết tủa màu trắng
a/ tính thể tích dung dịch K2SO4 phản ứng ?
b/ tính nồng độ mol chất sau phản ứng ?
cho K=39, S=32, Ba=137, O=16, Cl=35,5
\(n_{BaCl_2}=0.2\cdot0.5=0.1\left(mol\right)\)
\(BaCl_2+K_2SO_4\rightarrow BaSO_4+2KCl\)
\(0.1.............0.1.........................0.2\)
\(V_{dd_{K_2SO_4}}=\dfrac{0.1}{1}=0.1\left(l\right)\)
\(V_{dd}=0.2+0.1=0.3\left(l\right)\)
\(C_{M_{KCl}}=\dfrac{0.2}{0.3}=0.67\left(M\right)\)
Đổi 200ml = 0,2 lít
Ta có: \(n_{BaCl_2}=0,5.0,2=0,1\left(mol\right)\)
a. PTHH: \(BaCl_2+K_2SO_4--->BaSO_4\downarrow+2KCl\)
Theo PT: \(n_{K_2SO_4}=n_{BaCl_2}=0,1\left(mol\right)\)
\(\Rightarrow V_{dd_{K_2SO_4}}=\dfrac{0,1}{1}=0,1\left(lít\right)\)
b. Theo PT: \(n_{KCl}=2.n_{BaCl_2}=2.0,1=0,2\left(mol\right)\)
Ta có: \(V_{dd_{KCl}}=V_{dd_{BaCl_2}}=0,1\left(lít\right)\)
\(\Rightarrow C_{M_{KCl}}=\dfrac{0,2}{0,1}=2M\)
Câu 4:
a. Tính khối lượng của 4,48 lít khí SO2(ở đktc).
b. Tính thể tích ở đktc của 6,4 gam khí CH4.
(Cho biết NTK của: S : 32; O: 16; C: 12; H: 1; Mg: 24)
a)
\(n_{SO_2\left(dktc\right)}=\dfrac{V}{22,4}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\\ m_{SO_2}=n\cdot M=0,2\cdot\left(32+16\cdot2\right)=12,8\left(g\right)\)
b)
\(n_{CH_4}=\dfrac{m}{M}=\dfrac{6,4}{12+1\cdot4}=0,4\left(mol\right)\\ V_{CH_4\left(dktc\right)}=n\cdot22,4=0,4\cdot22,4=8,96\left(l\right)\)