đốt cháy 16.8 gam sắt cần v dung tích khí ở đktc, tính v và tính khối lượng ô xít thu được

Những câu hỏi liên quan
Đốt cháy hoàn toàn 46,4 gam sắt trong không khí thì thu được sắt lll oxit là Fe2O3. a/tính khối lượng sắt lll oxit và tính khối lượng oxi cần dùng theo hai cách. b/Tính thể tích không khí cần dùng (ở đktc)? Biết Vo2 = 1/5 Vkk

nFe = 46,4/56 = 29/35 (mol)
PTHH: 4Fe + 3O2 -> (t°) 2Fe2O3
Mol: 29/35 ---> 87/140 ---> 29/70
mFe2O3 = 29/70 . 160 = 464/7 (g)
Vkk = 87/140 . 5 . 22,4 = 69,6 (l)
Đúng 1
Bình luận (0)
Cho dòng khí CO dư qua ống chứa 1,6 gam sắt (III) ô xít nung nóng, thu được sắt và khí cacbonic.
a/ Tính khối lượng sắt thu được sau phản ứng
b/ Tính thể tích khí cacbonic ở đktc tạo thành.
a/ Số mol của sắt oxit là: nFe2O3 = 1,6 : (56*2 +16*3) = 0,01 mol
PTHH : 3CO + Fe2O3 ____> 2Fe + 3CO2
3 1 2 3
0,03mol <__ 0,01 mol __> 0,02 mol ----> 0,03 mol
Khối lượng sắt thu được là: mFe = 0,02 * 56 = 1,12 (g)
b/ Thể tích cacbonic là: 0,03 * 22,4 = 0,672 (l)
ĐS:...
Đúng 0
Bình luận (0)
4. Khi đốt cháy sắt trong oxi ở nhiệt độ cao thu được oxit sắt từ Fe3O4. a) Tính khối lượng sắt và thể tích khí oxi (đktc) cần dùng để điều chế được 6,96 gam Fe3O4 . b) Tính khối lượng kali clorat KClO3 cần dùng để điều chế được lượng oxi dùng cho phản ứng trên.
a. \(n_{Fe_3O_4}=\dfrac{6,96}{232}=0,03\left(mol\right)\)
PTHH : 3Fe + 2O2 -to-> Fe3O4
0,09 0,06 0,03
\(m_{Fe}=0,09.56=5,04\left(g\right)\)
\(V_{O_2}=0,06.22,4=1,344\left(l\right)\)
b. PTHH : 2KCl + 3O2 -> 2KClO3
0,06 0,04
\(m_{KClO_3}=0,04.122,5=4,9\left(g\right)\)
Đúng 2
Bình luận (0)
4
n Fe3O4=\(\dfrac{6,96}{232}=0,03mol\)
3Fe+2O2-to>Fe3O4
0,09---0,06-----0,03 mol
=>m Fe=0,09.56=5,04g
=>VO2=0,06.22,4=1,344l
b)
2KClO3-to>2KCl+3O2
0,04----------------------0,06 mol
=>m KClO3=0,04.122,5=4,9g
Đúng 0
Bình luận (1)
\(n_{Fe_3O_4}=\dfrac{6,96}{232}=0,03\left(mol\right)\\ 3Fe+2O_2\rightarrow\left(t^o\right)Fe_3O_4\\ n_{Fe}=3.0,03=0,09\left(mol\right);n_{O_2}=0,03.2=0,06\left(mol\right)\\ a,\Rightarrow m_{Fe}=0,09.56=5,04\left(g\right);V_{O_2\left(đktc\right)}=0,06.22,4=1,344\left(l\right)\\ 2KClO_3\rightarrow\left(t^o\right)2KCl+3O_2\uparrow\\ n_{KClO_3}=\dfrac{2}{3}.n_{O_2}=\dfrac{2.0,06}{3}=0,04\left(mol\right)\\ \Rightarrow b,m_{KClO_3}=122,5.0,04=4,9\left(g\right)\)
Đúng 0
Bình luận (1)
Xem thêm câu trả lời
Đốt cháy hoàn toàn 33,6 gam Sắt trong không khí thu được Oxit Sắt từ.
a. Tính thể tích không khí cần dùng ở Đktc biết VO2 = 20% Vkk
b. Tính khối lượng Oxit Sắt từ sau phản ứng?
\(n_{Fe}=\dfrac{33,6}{56}=0,6mol\)
\(3Fe+2O_2\rightarrow\left(t^o\right)Fe_3O_4\)
0,6 0,4 0,2 ( mol )
\(V_{kk}=0,4.22,4.5=44,8l\)
\(m_{Fe_3O_4}=0,2.232=46,4g\)
Đúng 1
Bình luận (0)
3Fe+2O2-to>Fe3O4
0,6-----0,4-------0,2 mol
n Fe=\(\dfrac{33,6}{56}\)=0,6 mol
=>Vkk=0,4.5.22,4=44,8l
m Fe3O4=0,2.232=46,4g
Đúng 1
Bình luận (0)
nFe = 33,6 / 56 = 0,6 mol
pthh: 3Fe + 2O2 --to-> Fe3O4
0,6 ----------> 0,4 -------> 0,2
a. VO2 = 0,4 * 22,4 = 8,96 lít
VO2 = 20% Vkk => Vkk = 8,96 * 100 / 20 = 44,8 lít
b. mFe3O4 = 0,2 * 232 = 46,4g
Đúng 0
Bình luận (2)
Đốt cháy hoàn toàn 3,36 gam sắt Fe ở nhiệt độ cao thu được oxit sắt từ Fe3O4.
a/ Tính khối lượng oxit sắt từ thu được sau phản ứng.
b/ Tính thề tích khí oxi cần dùng (đktc).
a) \(n_{Fe}=\dfrac{3,36}{56}=0,06\left(mol\right)\)
PTHH: 3Fe + 2O2 --to--> Fe3O4
0,06->0,04------->0,02
=> mFe3O4 = 0,02.232 = 4,64 (g)
b) VO2 = 0,04.22,4 = 0,896 (l)
Đúng 4
Bình luận (0)
Câu 3: Đốt cháy hoàn toàn 16,8 gam Sắt (Fe) trong không khía) Tính khối lượng sản phẩm thu được?b) Tính thể tích khí oxi, và thể tích không.khí cần dùng ở đktc? (biết rằng oxi chiếm 20% thể tích không khí)c) Tính khối lượng KMnO4 cần dùng để điều chế đủ oxi cho phản ứng trên? Biết rằng lượng oxi thu được hao hụt 20%Cho biết: Fe 56, O 16, K 39, Mn 55
Đọc tiếp
Câu 3: Đốt cháy hoàn toàn 16,8 gam Sắt (Fe) trong không khí
a) Tính khối lượng sản phẩm thu được?
b) Tính thể tích khí oxi, và thể tích không.khí cần dùng ở đktc? (biết rằng oxi chiếm 20% thể tích không khí)
c) Tính khối lượng KMnO4 cần dùng để điều chế đủ oxi cho phản ứng trên? Biết rằng lượng oxi thu được hao hụt 20%
Cho biết: Fe = 56, O = 16, K = 39, Mn = 55
a.b.
\(n_{Fe}=\dfrac{16,8}{56}=0,3mol\)
\(3Fe+2O_2\rightarrow\left(t^o\right)Fe_3O_4\)
0,3 0,2 0,1 ( mol )
\(m_{Fe_3O_4}=0,1.232=23,2g\)
\(V_{O_2}=0,2.22,4=4,48l\)
\(V_{kk}=4,48.5=22,4l\)
c.
\(2KMnO_4\rightarrow\left(t^o\right)K_2MnO_4+MnO_2+O_2\)
0,4 0,2 ( mol )
\(m_{KMnO_4}=\dfrac{0,4.158}{\left(100-20\right)\%}=79g\)
Đúng 2
Bình luận (4)
a/ Số mol Fe là : nFe = 16,8: 56 = 0,3 mol
PTPƯ:
3Fe + 2O2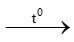 Fe3O4 (1)
Fe3O4 (1)
0,3 mol → 0,2mol → 0,1 mol
Từ (1) ta có số mol Fe3O4 = 0,1mol
→ m Fe3O4 = n.M = 0,1.232 = 23,2gam
b/ Từ (1) ta có số mol O2 đã dùng nO2 = 0,2 mol
Thể tích khí oxi đã dùng ở đktc: VO2 = n.22,4 = 0,2.22,4 = 4,48 lít
Thể tích không khí đã dùng: Vkk = 5. VO2= 5.4,48 = 22,4 lít.
c/ PTPƯ
2 KMnO4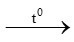 K2MnO4 + MnO2 + O2 (2)
K2MnO4 + MnO2 + O2 (2)
0,4444mol ← 0,222mol
Vì lượng Oxi thu được hao hụt 10% nên số mol O2 cần có là:
nO2 = 0,2mol.100/90 = 0.222 mol
Từ (2) ta có số mol KMnO4 = 0,444mol
Khối lượng KMnO4 bị nhiệt phân
mKMnO4 = n.M = 0,444.158 = 70.152 gam
Đúng 1
Bình luận (18)
Đốt cháy hết 5,04 gam kim loại sắt trong lọ chứa khí oxi dư, sau phản ứng thu được oxit sắt từ.
a. Tính khối lượng sản phẩm tạo thành.
b. Tính thể tích oxi và thể tích KK cần dùng ở đktc, biết
nFe = 5,04 / 56 = 0,09 ( mol)
3Fe + 2O2 --(t^o)-- > Fe3O4
0,09 0,06 0,03 (mol)
=> mFe3O4 = 0,03 . 232 = 6,9(g)
=> VO2 = 0,06 . 22,4 = 1,344 (l)
=> Vkk = 1,344 . 5 = 6,72(l)
Đúng 4
Bình luận (0)
cho 5.4 gam nhôm vào dung dịch HCl,phản ứng hoàn toàn
a) Tính thể tích khí thu được ở đktc?
b) Tính khối lượng HCl cần dùng?
c) Khí thu được đốt cháy hoàn toàn.Tinh1 thể tích không khí cần đốt hết lượng hiđro(khí đo ở đktc)?
cho 5.4 gam nhôm vào dung dịch HCl, phản ứng hoàn toàn
a) tính thể tích khí thu được ở đktc?
b) tính khối lượng HCl cần dùng?
c) khí thu được đốt cháy hoàn toàn.Tính thể tích không khí cần đốt hết lượng hiđro trên (khí đo ở đktc)
Al + 3HCl -> AlCl3 + \(\frac{3}{2}\)H2
a.
nAl = 5.4/27 = 0.2 mol
nH2 = 0.2 x 3/2 = 0.3 mol
=> VH2 = 0.3 x 22.4 = 6.72 lit
b.
nHCl = 0.2 x 3 = 0.6 mol
mHCl = 0.6 x 36.5 = 21.9 g (Khối lượng HCl Khan. Cái này ko có nồng độ nên không tính được khối lượng dung dịch)
c.
H2 + \(\frac{1}{2}\)O2 -> H2O
nO2 = 0.3/2 = 0.15 mol
=> VO2 = 0.15 x 22.4 = 3.36 lit
O2 chiếm 21% thể tích không khí
=> VKK = 3.36 x 100 / 21 = 16 lit
Đúng 0
Bình luận (0)
Al + 3HCl -> AlCl3 + \(\frac{3}{2}\)H2
a.
nAl = 5.4/27 = 0.2 mol
nH2 = 0.2 x 3/2 = 0.3 mol
=> VH2 = 0.3 x 22.4 = 6.72 l
b.
nHCl = 0.2 x 3 = 0.6 mol
mHCl = 0.6 x 36.5 = 21.9 g
c.
H2 + \(\frac{1}{2}\)O2 -> H2O
nO2 = 0.3/2 = 0.15 mol
=> VO2 = 0.15 x 22.4 = 3.36 l
O2 chiếm 21% thể tích không khí
=> VKK = 3.36 x 100 / 21 = 16 l
Đúng 0
Bình luận (0)
Khối lượng HCl Khan.Không có nồng độ -> không tính được khối lượng dd
Đúng 0
Bình luận (0)
Xem thêm câu trả lời

























