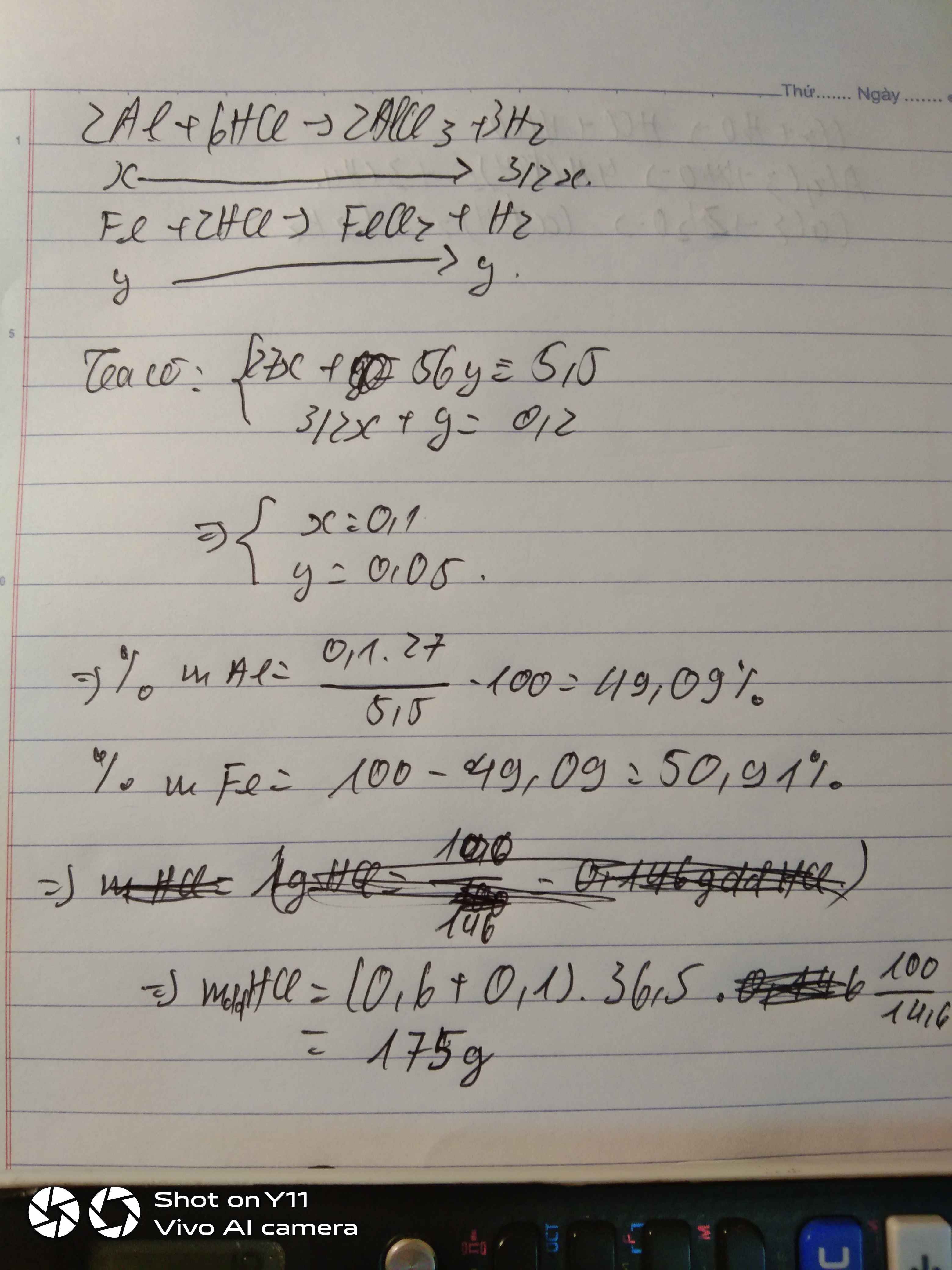Hòa tan 4g hỗn hợp gồm Mg và Fe trong dung dịch HCl dư, thu được 2,24 lít khí hidro (đktc). Tính phần trăm khối lượng mỗi kim loại trong hỗn hợp.

Những câu hỏi liên quan
Một hỗn hợp A gồm Ca và Mg có khối lượng 8,8g. Nếu hòa tan hết hỗn hợp này trong nước thì thu được 2,24 lít khí hidro (đktc).
a) Tính khối lượng mỗi kim loại trong hỗn hợp A.
b) Nếu hòa tan hết cũng lượng hỗn hợp trên trong dung dịch HCl thì thể tích H2 (đktc) thu được là bao nhiêu?
a.
Số mol H2: nH2=2,24/22,4 =0,1 mol
Vì chỉ có Ca tác dụng với nước nên:
PT: Ca + 2H2O-->Ca(OH)2 + H2
0,1<--------------------------0,1 mol
Khối lượng Ca: mCa=0,1.40=4 g
mMg=8,8-4=4,8 g
b.
Trong hỗn hợp A:
nCa=4/40=0,1 mol
nMg=4,8/24=0,2 mol
PT:
Ca + 2HCl------->CaCl2 + H2
0,1-----------------------------0,1 mol
Mg + 2HCl-------->MgCl2 + H2
0,2--------------------------------0,2 mol
nH2=0,1 + 0,2=0,3 mol
Thể tích H2:
VH2=0,3.22,4=6,72 l
Đúng 0
Bình luận (0)
Cho 50g hỗn hợp gồm Mg và Cu vào dung dịch Hcl dư. Sau phản ứng thu được 13,44g lít khí hidro ở đktc
a, tính khối lượng mỗi kim loại trong hỗn hợp ban đầu
b, tính phần trăm về khối lượng mỗi kim loại trong hỗn hợp ban đầu
PTHH: \(Mg+2HCl\rightarrow MgCl_2+H_2\)
\(n_{H_2}=\dfrac{13,44}{22,4}=0,6\left(mol\right)\)
Theo PTHH: \(n_{Mg}=n_{H_2}=0,6\left(mol\right)\)
=> \(m_{Mg}=0,6.24=14,4\left(g\right)\)
=> \(m_{Cu}=50-14,4=35,6\left(g\right)\)
\(\Rightarrow\left\{{}\begin{matrix}\%Mg=\dfrac{14,4}{50}.100=28,8\%\\\%Cu=\dfrac{35,6}{50}.100=71,2\%\end{matrix}\right.\)
Đúng 1
Bình luận (0)
\(n\)H2 =\(\dfrac{13,44}{22,4}\) =0,6(mol)
PTHH:
Mg +HCl →MgCl2 + H2
0,6 mol ←0,6 mol
a) \(m\)Mg =0,6. 24 =14,4(g)
\(m\)Cu= 50- 14,4= 35,6(g)
b)\(m\)%Mg= \(\dfrac{14,4}{50}\).100%= 28,8%
\(m\)%Cu=100%- 28,8%= 71,2%
Đúng 0
Bình luận (1)
Hoà tan hoàn toàn 5,2 gam hỗn hợp gồm Mg và Fe bằng dung dịch HCl 1M thì thu được 3,36 lít khí H2 (đktc).
1) Tính thành phần phần trăm theo khối lượng mỗi kim loại có trong hỗn hợp.
2) Tính thể tích dung dịch HCl đã dùng.
\(1)n_{H_2}=\dfrac{3,36}{22,4}=0,15(mol)\\ Mg+2HCl\to MgCl_2+H_2\\ Fe+2HCl\to FeCl_2+H_2\)
Từ giả thiết và theo PT:
\(\begin{cases} 24n_{Mg}+56n_{Fe}=5,2\\ n_{Mg}+n_{Fe}=0,15 \end{cases}\\ \Rightarrow n_{Mg}=0,1(mol);n_{Fe}=0,05(mol)\)
\(\Rightarrow \begin{cases} \%m_{Mg}=\dfrac{0,1.24}{5,2}.100\%=46,15\%\\ \%m_{Fe}=100-46,15=53,85\% \end{cases}\\ 2)\Sigma n_{HCl}=2n_{H_2}=0,3(mol)\\ \Rightarrow V_{dd_{HCl}}=\dfrac{0,3}{1}=0,3(l)=300(ml)\)
Đúng 3
Bình luận (1)
hòa tan hoàn toàn 5,5 gam hỗn hợp gồm Al, Fe bằng dung dịch HCl vừa đủ thu được 4,48 lít khí hidro dkc
a . tính phần trăm khối lượng mỗi kim loại trong hỗn hợp đồng
b. tính khối lượng dung dịch HCl cần dùng nếu cứ 100 gam dung dịch HCl có chứa 14,6 gam HCl nguyên chất
Gọi \(\left\{{}\begin{matrix}n_{Al}=x\left(mol\right)\\n_{Fe}=y\left(mol\right)\end{matrix}\right.\)
\(n_{H_2}=\dfrac{4,48}{22,4}=0,2mol\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
Theo pt: \(\Rightarrow\left\{{}\begin{matrix}3x+y=0,2\\27x+56y=5,5\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=\dfrac{19}{470}\\y=\dfrac{37}{470}\end{matrix}\right.\)
\(\%m_{Al}=\dfrac{\dfrac{19}{470}\cdot27}{5,5}\cdot100\%=19,84\%\)
\(\%m_{Fe}=100\%-19,84\%=80,16\%\)
Hòa tan hoàn toàn 13,8 gam hỗn hợp A gồm hai kim loại Fe, Al vào 750 ml dung dịch HCl 1,6M (D = 1,1g/ml) thu được 10,08 lít khí (đktc) và dung dịch B.
Tính phần trăm về khối lượng mỗi kim loại trong hỗn hợp A.
Cho 20,8gam hỗn hợp X gồm Fe và Mg tác dụng hết với lượng dư dung dịch HCl,thu được Y là 13,44 lít khí (đktc).tính phần trăm khối lượng mỗi kim loại trong X
Xem chi tiết
Ta có: \(n_{H_2}=\dfrac{13,44}{22,4}=0,6\left(mol\right)\)
\(\overset{o}{Fe}\rightarrow\overset{+2}{Fe}+2e\) \(\overset{+1}{2H}+2e\rightarrow\overset{0}{H_2}\)
x - - - - - -> 2x (mol) 1.2 < - - 0,6
\(\overset{0}{Mg}\rightarrow\overset{+2}{Mg}+2e\)
y - - - - - - - > 2y (mol)
Bảo toàn electron: \(2x+2y=1,2\)
Mà \(56x+24y=20,8\)
\(\Rightarrow\left\{{}\begin{matrix}x=0,2\\y=0,4\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}\%m_{Fe}=\dfrac{0,2\cdot56}{20,8}\cdot100\%\approx53,85\%\\\%m_{Mg}=46,15\%\end{matrix}\right.\)
Đúng 2
Bình luận (0)
Hòa tan hoàn toàn 6,3(g) hỗn hợp 2 kim loại Al và Mg vào dung dịch Hcl vừa đủ thu được 6,72 lít khí (đktc)
Tính phần trăm khối lượng mỗi kim loại trong hỗn hợp.
Chia hỗn hợp X gồm K, AI và Fe thành hai phần bằng nhau. Cho phần một vào dung dịch KOH (dư) thu được 0,784 lít khí H2 (đktc). Cho phần hai vào một lượng dư H2O, thu được 0,448 lít khí H2 (đktc) và m gam hỗn hợp kim loại Y. Hòa tan hoàn toàn Y vào dung dịch HCl (dư) thu được 0,56 lít khí H2 (đktc). Khối lượng (tính theo gam) của K, Al, Fe trong mỗi phần hỗn hợp X lần lượt là A. 0,39; 0,54; 1,40. B. 0,78; 0,54;1,12 C. 0,39; 0,54; 0,56 D. 0,78; 1,08;0,56
Đọc tiếp
Chia hỗn hợp X gồm K, AI và Fe thành hai phần bằng nhau.
Cho phần một vào dung dịch KOH (dư) thu được 0,784 lít khí H2 (đktc).
Cho phần hai vào một lượng dư H2O, thu được 0,448 lít khí H2 (đktc) và m gam hỗn hợp kim loại Y. Hòa tan hoàn toàn Y vào dung dịch HCl (dư) thu được 0,56 lít khí H2 (đktc).
Khối lượng (tính theo gam) của K, Al, Fe trong mỗi phần hỗn hợp X lần lượt là
A. 0,39; 0,54; 1,40.
B. 0,78; 0,54;1,12
C. 0,39; 0,54; 0,56
D. 0,78; 1,08;0,56
Hòa tan hòan tòan 18.8g hỗn hợp gồm Mg và Fe bằng dung dịch HCl dư thu được 10.08 lit khí (đktc).Tìm thành phần % khối lượng các kim loại trong hỗn hợp đầu .
\(n_{Mg}=a\left(mol\right),n_{Fe}=b\left(mol\right)\)
\(m_{hh}=24a+56b=18.8\left(g\right)\left(1\right)\)
\(n_{H_2}=\dfrac{10.08}{22.4}=0.45\left(mol\right)\)
\(Mg+2HCl\rightarrow MgCl_2+H_2\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(\Rightarrow a+b=0.45\left(2\right)\)
\(\left(1\right),\left(2\right):a=0.2,b=0.25\)
\(\%Mg=\dfrac{0.2\cdot24}{18.8}\cdot100\%=25.53\%\)
\(\%Fe=100-25.53=77.47\%\)
Đúng 0
Bình luận (0)
Đặt \(\left\{{}\begin{matrix}n_{Mg}=a\left(mol\right)\\n_{Fe}=b\left(mol\right)\end{matrix}\right.\) \(\Rightarrow24a+56b=18,8\) (1)
Ta có: \(n_{H_2}=\dfrac{10,08}{22,4}=0,45\left(mol\right)\)
Bảo toàn electron: \(2a+2b=0,9\) (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}a=0,2\\b=0,25\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Mg}=\dfrac{0,2\cdot24}{18,8}\cdot100\%\approx25,53\%\\\%m_{Fe}=74,47\%\end{matrix}\right.\)
Đúng 0
Bình luận (0)
Xem thêm câu trả lời