Cho m g Al vào dung dịch HCl dư dến khi ngừng thoát khí thì thấy khối lượng dung dịch tăng 14,4 g so với dd HCl ban đầu. Tính khối lượng muối tạo thành :
A. 71,2g
B. 80,1g
C. 16,2g
D. 14,4g
Cho m gam Al vào dung dịch HCl dư đến khi ngừng thoát khí thấy khối lượng phần dung dịch tăng 14,4 gam so với dung dịch HCl ban đầu. Tính khối lượng muối tạo thành.
A. 71,2 gam.
B. 80,1 gam.
C. 16,2 gam.
D. 14,4 gam.
Chọn đáp án B
2Al + 6HCl → 2AlCl3 + 3H2↑. Bảo toàn khối lượng:
mAl + mdung dịch HCl = mdung dịch sau phản ứng + mH2.
⇒ mtăng = mdung dịch sau – mdung dịch HCl = mAl – mH2 = 14,4(g).
Mặt khác, nH2 = 1,5.nAl ||⇒ giải hệ có: nAl = 0,6 mol; nH2 = 0,9 mol.
► mmuối = 0,6 × 133,5 = 80,1(g) ⇒ chọn B.
dễ thế , đi copy trang khác xong vô paste lại là xong bạn nhỉ?
Cho m gam Al vào dung dịch HCl dư đến khi ngừng thoát khí thấy khối lượng phần dung dịch tăng 14,4 gam so với dung dịch HCl ban đầu. Tính khối lượng muối tạo thành.
A. 71,2 gam.
B. 80,1 gam.
C. 16,2 gam.
D. 14,4 gam.
Chọn đáp án B
2Al + 6HCl → 2AlCl3 + 3H2↑. Bảo toàn khối lượng:
mAl + mdung dịch HCl = mdung dịch sau phản ứng + mH2.
⇒ mtăng = mdung dịch sau – mdung dịch HCl = mAl – mH2 = 14,4(g).
Mặt khác, nH2 = 1,5.nAl ||⇒ giải hệ có: nAl = 0,6 mol; nH2 = 0,9 mol.
► mmuối = 0,6 × 133,5 = 80,1(g) ⇒ chọn B.
dễ thế , đi copy trang khác xong vô paste lại là xong bạn nhỉ?
Câu 3 : Cho 11,9 gam hỗn hợp gồm 2 kim loại Zn và Al tác dụng với dd HCl dư thấy thoát ra 9,916 lít khí H2 (đkc). a) Tính khối lượng mỗi kim loại trong hỗn hợp ban đầu. b) Tính khối lượng muối tạo thành. c) Tính khối lượng dung dịch HCl 10% cần dùng
a, Ta có: 65nZn + 27nAl = 11,9 (1)
PT: \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
Theo PT: \(n_{H_2}=n_{Zn}+\dfrac{3}{2}n_{Al}=\dfrac{9,916}{24,79}=0,4\left(mol\right)\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{Zn}=0,1\left(mol\right)\\n_{Al}=0,2\left(mol\right)\end{matrix}\right.\)
⇒ mZn = 0,1.65 = 6,5 (g)
mAl = 0,2.27 = 5,4 (g)
b, Theo PT: nZnCl2 = nZn = 0,1 (mol)
nAlCl3 = nAl = 0,2 (mol)
⇒ m muối = 0,1.136 + 0,2.133,5 = 40,3 (g)
c, Theo PT: nHCl = 2nH2 = 0,8 (mol)
\(\Rightarrow m_{ddHCl}=\dfrac{0,8.36,5}{10\%}=292\left(g\right)\)
Giả sử: \(\left\{{}\begin{matrix}n_{Mg}=x\left(mol\right)\\n_{Al}=y\left(mol\right)\end{matrix}\right.\)
⇒ 24x + 27y = 7,8 (1)
Ta có: \(n_{H_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
BT e, có: 2x + 3y = 0,8 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,1\left(mol\right)\\y=0,2\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{Mg}=0,1.24=2,4\left(g\right)\\m_{Al}=0,2.27=5,4\left(g\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Mg}=\dfrac{2,4}{7,8}.100\%\approx30,77\%\\\%m_{Al}\approx69,23\%\end{matrix}\right.\)
b, BTNT Mg và Al, có:
nMgCl2 = nMg = 0,1 (mol)
nAlCl3 = nAl = 0,2 (mol)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{MgCl_2}=\dfrac{0,1.95}{0,1.95+0,2.133,5}.100\%\approx26,24\%\\\%m_{AlCl_3}\approx73,76\%\end{matrix}\right.\)
Bạn tham khảo nhé!
hòa tan 15,6 g hỗn hợp gồm Al và Mg trong dung dịch HCl dư. Sau khi phản ứng kết thúc thu được dung dịch có khối lượng tăng thêm 14 g so với dung dịch HCl ban đầu. Tính % khối lượng từng kim loại ban đầu
\(n_{H_2} = \dfrac{15,6-14}{2} = 0,8(mol)\\ 2Al + 6HCl \to 2AlCl_3 + 3H_2\\ Mg + 2HCl \to MgCl_2 + H_2\)
Gọi \(n_{Al} = a \ mol;n_{Mg} = b\ mol\)
Ta có :
\(\left\{{}\begin{matrix}27a+24b=15,6\\1,5a+b=0,8\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}a=0,4\\b=0,2\end{matrix}\right.\)
Vậy :
\(\%m_{Al} = \dfrac{0,4.27}{15,6}.100\% = 69,23\%\\ \%m_{Mg} = 100\% - 69,23\% = 30,77\%\)
Hỗn hợp X gồm Ag2SO4 và CuSO4 hòa tan vào nước dư được dung dịch A. Cho m g bột Al vào dung dịch A một thời gian thu được 6,66 g chất rắn B và dung dịch C. Chia B làm 2 phần bằng nhau. Cho phần thứ nhất vào dung dịch NaOH dư thấy thoát ra 3,024 lít H2(đktc). Hoà tan phần thứ 2 bằng dung dịch HNO3 loãng dư thu được 2,91 g khí NO sản phẩm khử duy nhất. Thêm HCl dư vào dung dịch C không thấy xuất hiện kết tủa, thu được dung dịch D. Nhúng một thanh Fe vào dung dịch D cho đến khi dung dịch mất hết màu xanh và lượng khí H2 thoát ra là 0,896 lít (đktc) thì nhấc thanh sắt ra thấy khối lượng thanh sắt giảm đi 2,144 g so với ban đầu (kim loại giải phóng ra bám hoàn toàn trên thanh sắt). Biết các phản ứng liên quan đến dãy điện hóa xảy ra theo thứ tự chất nào oxi hóa mạnh hơn phản ứng trước, % khối lượng muối Ag2SO4 trong hỗn hợp X là:
A. 16,32 %
B. 27,20%
C. 24,32%
D. 18,64 %
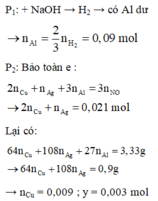
Trong 6,66g B có : 0,018 mol Cu ; 0,006 mol Ag ; 0,18 mol Al
Dung dịch C + HCl không tạo kết tủa → không có Ag+
+) Dung dịch D + thanh Fe
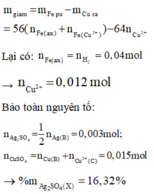
Đáp án A
Hỗn hợp X gồm Ag2SO4 và CuSO4 hòa tan vào nước dư được dung dịch A. Cho m g bột Al vào dung dịch A một thời gian thu được 6,66 g chất rắn B và dung dịch C. Chia B làm 2 phần bằng nhau. Cho phần thứ nhất vào dung dịch NaOH dư thấy thoát ra 3,024 lít H2(đktc). Hoà tan phần thứ 2 bằng dung dịch HNO3 loãng dư thu được 2,91 g khí NO sản phẩm khử duy nhất. Thêm HCl dư vào dung dịch C không thấy xuất hiện kết tủa, thu được dung dịch D. Nhúng một thanh Fe vào dung dịch D cho đến khi dung dịch mất hết màu xanh và lượng khí H2 thoát ra là 0,896 lít (đktc) thì nhấc thanh sắt ra thấy khối lượng thanh sắt giảm đi 2,144 g so với ban đầu (kim loại giải phóng ra bám hoàn toàn trên thanh sắt). Biết các phản ứng liên quan đến dãy điện hóa xảy ra theo thứ tự chất nào oxi hóa mạnh hơn phản ứng trước, % khối lượng muối Ag2SO4 trong hỗn hợp X là:
A. 16,32 %
B. 27,20%
C. 24,32%
D. 18,64 %
Đáp án A
P1: + NaOH → H2 → có Al dư → n A l = 2 3 n H 2 = 0 , 09 m o l
P2: Bảo toàn e: 2 n C u + n A g + 3 n A l = 3 n N O → 2 n C u + n A g = 0 , 021 m o l
Lại có: 64 n C u + 108 n A g + 27 n A l = 3 , 33 g → 64 n C u + 108 n A g = 0 , 9 g
→ n C u = 0 , 009 ; y = 0 , 003 m o l
Trong 6,66g B có: 0,018 mol Cu ; 0,006 mol Ag ; 0,18 mol Al
Dung dịch C + HCl không tạo kết tủa → không có Ag+
+) Dung dịch D + thanh Fe:
m g i ả m = m F e p ư - m C u r a = 56 ( n F e ( a x ) + n F e ( C u 2 + ) ) - 64 n C u 2 +
Lại có: n F e ( a x ) = n H 2 = 0 , 04 m o l → n C u 2 + = 0 , 012 m o l
Bảo toàn nguyên tố:
n A g 2 S O 4 = 1 / 2 n A g ( B ) = 0 , 003 m o l ; n C u S O 4 = n C u ( B ) + n C u ( C ) 2 + = 0 , 015 m o l
→ m A g 2 S O 4 ( X ) = 16 , 32 %
Hòa tan 28,4 gam hỗn hợp CaCO3 và MgCO3 bằng dung dịch HCl (dư) thấy thoát ra 6,72 lít khí (đktc).
a) Tính thành phần % về khối lượng của hỗn hợp muối ban đầu.
b) Tính thể tích dung dịch HCl 29,2% (D = 1,25 g/ml) đã dùng, biết đã dùng dư 1% so với lượng phản ứng.
Các bạn giúp mình giải bài này với.
Cảm ơn các bạn 😃.
a)
Gọi $n_{CaCO_3} = a; n_{MgCO_3} = b$
$\Rightarrow 100a + 84b = 28,4(1)$
$CaCO_3 + 2HCl \to CaCl_2 + CO_2 + H_2O$
$MgCO_3 + 2HCl \to MgCl_2 + CO_2 + H_2O$
$n_{CO_2} = a + b = \dfrac{6,72}{22,4} = 0,3(2)$
Từ (1)(2) suy ra a = 0,2 ; b = 0,1
$\%m_{CaCO_3} = \dfrac{0,2.100}{28,4}.100\% = 70,42\%$
$\%m_{MgCO_3} = 100\% -70,42\% = 29,58\%$
b)
$n_{HCl\ pư} = 2n_{CO_2} = 0,6(mol)$
$n_{HCl\ dư} = 0,6.1\% = 0,006(mol)$
$n_{HCl\ đã\ dùng} = 0,6 + 0,006 = 0,606(mol)$
$m_{dd\ HCl} = \dfrac{0,606.36,5}{29,2\%} = 75,75(gam)$
$V_{dd\ HCl} = \dfrac{75,75}{1,25} = 60,6(ml)$
Hòa tan 14,4 g FeO vào 200g dung dịch HCl 10,95%
a) Có chất nào dư không? Nếu dư thì khối lượng bao nhiêu?
b) Tính khối lượng muối tạo thành
c) Tính nồng độ phần trăm các chất của dung dịch sau phản ứng
\(n_{FeO}=\dfrac{14,4}{72}=0,2\left(mol\right)\)
\(m_{ct}=\dfrac{10,95.200}{100}=21,9\left(g\right)\)
\(n_{HCl}=\dfrac{21,9}{36,5}=0,6\left(mol\right)\)
Pt : \(FeO+2HCl\rightarrow FeCl_2+H_2O|\)
1 2 1 1
0,2 0,6 0,2
a) Lập tỉ số so sánh : \(\dfrac{0,2}{1}< \dfrac{0,6}{2}\)
⇒ FeO phản ứng hết , HCl dư
⇒ Tính toán dựa vào số mol của FeO
\(n_{HCl\left(dư\right)}=0,6-\left(0,2.2\right)=0,2\left(mol\right)\)
⇒ \(m_{HCl\left(dư\right)}=0,2.36,5=7,3\left(g\right)\)
b) \(n_{FeCl2}=\dfrac{0,2.1}{1}=0,2\left(mol\right)\)
⇒ \(m_{FeCl2}=0,2.127=25,4\left(g\right)\)
\(m_{ddspu}=14,4+200=214,4\left(g\right)\)
\(C_{FeCl2}=\dfrac{25,4.100}{214,4}=11,85\)0/0
\(C_{HCl\left(dư\right)}=\dfrac{7,3.100}{214,4}=3,4\)0/0
Chúc bạn học tốt
a,\(n_{FeO}=\dfrac{14,4}{72}=0,2\left(mol\right)\)
\(m_{HCl}=10,95\%.200=21,9\left(g\right)\Rightarrow n_{HCl}=\dfrac{21,9}{36,5}=0,6\left(mol\right)\)
PTHH: FeO + 2HCl → FeCl2 + H2O
Mol: 0,2 0,4 0,2
Ta có: \(\dfrac{0,2}{1}< \dfrac{0,6}{2}\) ⇒ FeO pứ hết ,HCl dư
mHCl dư = (0,6-0,4).36,5 = 7,3 (g)
b, \(m_{FeCl_2}=0,2.127=25,4\left(g\right)\)
c, mdd sau pứ = 14,4+200 = 214,4 (g)
\(C\%_{ddFeCl_2}=\dfrac{25,4.100\%}{214,4}=11,847\%\)
\(C\%_{ddHCldư}=\dfrac{7,3.100\%}{214,4}=3,4\%\)