Hòa tan hoàn toàn x mol C u F e S 2 bằng dung dịch H N O 3 đặc, nóng (dư) sinh ra y mol N O 2 (sản phẩm khử duy nhất của N + 5 ). Biểu thức liên hệ giữa x và y là
A. y = 17x
B. x = 15y
C. x =17y
D. y = 15x
Hòa tan hoàn toàn 2,52 gam hỗn hợp Mg và Al bằng dung dịch HCl thu được 2,688 lít hiđro (đktc). Cũng lượng hỗn hợp này nếu hòa tan hoàn toàn bằng H2SO4 đặc nóng thì thu được 0,12 mol một sản phẩm X duy nhất hình thành do sự khử S+6. X là :
A. S.
B. SO2.
C. H2S.
D. S hoặc SO2.
Hòa tan hoàn toàn hỗn hợp gồm 0,002 mol FeS2 và 0,003 mol FeS vào lượng dư dung dịch H2SO4 đặc nóng thu được Fe2(SO4)3, SO2 và H2O. Hấp thụ hết lượng SO2 trên bằng 1 lượng vừa đủ dung dịch KMnO4 thu được dung dịch X có pH = 2. Thể tích của dung dịch X là
A. 2,00 lít
B. 1,150 lít
C. 1,114 lít
D. 2,28 lít
Cách 1: Quy đổi số oxi hóa
Sau toàn bộ quá trình, số oxi hóa cuối cùng của lưu huỳnh là +4 (trong SO2).
Giả sử S trong FeS2 và FeS đều là S + 4 .
Khi đó, có các quá trình nhường và nhận electron như sau:
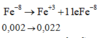
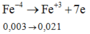
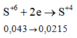

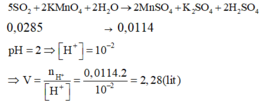
Đáp án D
Hòa tan hoàn toàn 2,4g hỗn hợp X gồm FeS2 , FeS, S (số mol FeS = số mol S) vào dung dịch
H2SO4 đặc nóng dư. Thể tích khí SO2 thoát ra ở đktc là :
A. 3,36 lít
B. 4,48 lít
C. 0,896 lít
D. 2,464 lít
Đáp án A
Quy đổi hỗn hợp về dạng 2,4g FeS2 => nFeS2 = 0,02 mol
Quá trình cho nhận e: FeS2 Fe+3 + 2S+6 + 15e
S+6 + 2e S+4
=> 2nSO2= 15nFeS2 => VSO2 = 3,36 l
Hòa tan hoàn toàn m gam hỗn hợp E gồm: KMnO4, K2Cr2O7, K2MnO4, MnO2, PbO2 ( các chất trong E có số mol bằng nhau) bằng dung dịch HCl (đặc nóng). Sau phản ứng thu được (m + 11,856) gam hỗn hợp muối X ( X gồm: KCl, MnCl2, CrCl3, PbCl2) và a mol khí Cl2. Giá trị a là?
A. 0,302. B. 0,304. C. 0,305. D. 0,306.
Mọi người giúp mình với! Thanks you very much!
Gọi :
\(n_{KMnO_4} = n_{K_2Cr_2O_7} = n_{K_2MnO_4} = n_{MnO_2} = n_{PbO_2} = x(mol)\)
Suy ra : 975x = m(1)
Bảo toàn nguyên tố với K,Mn,Cr,Pb ,Muối gồm :
\(\left\{{}\begin{matrix}KCl:x+2x+2x=5x\left(mol\right)\\MnCl_2:x+x+x=3x\left(mol\right)\\CrCl_3:2x\left(mol\right)\\PbCl_2:x\left(mol\right)\end{matrix}\right.\)
Suy ra : 1345,5x = m + 11,856(2)
Từ (1)(2) suy ra : m = 31,2 ; x = 0,032
Bảo toàn electron :
\(5n_{KMnO_4} + 6n_{K_2Cr_2O_7} + 4n_{K_2MnO_4} + 2n_{MnO_2} + 2n_{PbO_2} = 2n_{Cl_2}\)
Suy ra :
\(a = \dfrac{0,032.5+0,032.6 + 0,032.4 + 0,032.2 + 0,032.2}{2} = 0,304(mol)\)
(Đáp án B)
Hòa tan hoàn toàn 7,52g hỗn hợp H gồm S, FeS, FeS, FeS2 trong HNO3 đặc nóng, đã thu được 0,96 mol NO2 ( là sản phẩm khử duy nhất ) và dung dịch X. Cho dung dịch Ba(OH)2 dư vào dung dịch X lọc kết tủa, nung đến khối lượng không đổi thì khối lượng chất rắn thu được là
A. 30,29 gam
B. 36,71 gam
C. 36,71 gam
D. 36,71 gam
S, FeS, FeS2 + HNO3 → Fe3+ + SO42- + NO2↑
Khi cho Ba(OH)2 vào X, kết tủa là Fe(OH)3 và BaSO4
Coi hỗn hợp đầu gồm x mol Fe và y mol S
=> 56 x + 32 y = 7 , 52 3 x + 6 y = 0 , 96 → x = 0 , 06 y = 0 , 13
Bảo toàn nguyên tố => n Fe(OH)3 = 0,06 mol; n BaSO4 = 0,13 mol
Sau khi nung, chất rắn là Fe2O3 (0,03 mol) và BaSO4 (0,13 mol)
=> mc.rắn = 35,09 g
Đáp án D
Hòa tan hoàn toàn m gam hỗn hợp X gồm FeO, Fe(OH)2 và FeCO3 vào V lít dung dịch HNO3 1M, thu được dung dịch chỉ chứa một muối và 4,48 lít (đktc) hỗn hợp khí gồm CO2 và NO (sản phẩm khử duy nhất của N+5). Mặt khác, hòa tan hoàn toàn 0,15 mol X vào dung dịch H2SO4 (đặc, nóng, dư), thu được 2,8 lít (đktc) hỗn hợp khí gồm CO2 và SO2 (sản phẩm khử duy nhất của S+6. Giá trị của V là
A. 0,6.
B. 0,8.
C. 1,0.
D. 1,2.
Hòa tan hoàn toàn m gam hỗn hợp X gồm Al, Cu và FeS vào dung dịch chứa 0,32 mol H 2 S O 4 (đặc), đun nóng, thu được dung dịch Y (chất tan chỉ gồm các muối trung hòa) và 0,24 mol S O 2 (là chất khí duy nhất). Cho 0,25 mol NaOH phản ứng hết với dung dịch Y, thu được 7,63 gam kết tủa. Giá trị của m là
A. 5,61
B. 4,66.
C. 5,44
D. 5,34.
Đáp án A
Bảo toàn H có n H 2 O = n a x i t = 0,32 mol.
Bảo toàn O có:
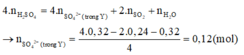
Cho NaOH phản ứng hết với Y, sau phản ứng dung dịch thu được chứa: N a + : 0,25 mol; S O 4 2 - : 0,12 mol; Al O 2 - x mol.
Bảo toàn điện tích → x = 0,25 – 2.0,12 = 0,01 (mol)
n O H - t r o n g ↓ = n O H - b a n đ ầ u – 4.nAl O 2 - = 0,25 – 4.0,01 = 0,21 (mol)
m K L t r o n g ↓ = m ↓ - m O H - t r o n g ↓ = 7,63 – 0,21.17 = 4,06 gam.
Bảo toàn S có:
n S t r o n g F e S + n S t r o n g a x i t = n S t r o n g k h ô n g k h í + n S t r o n g S O 4 2 - ở Y
→ n S t r o n g F e S = 0,24 + 0,12 – 0,32 = 0,04 mol
→ m = m K L t r o n g ↓ + m S t r o n g F e S + m A l t r o n g A l O 2 - = 4,06 + 0,04.32 + 0,01.27 = 5,61 gam.
Để khử hoàn toàn 3,04g hỗn hợp X gồm FeO, Fe2O3, Fe3O4, cần 0,55 mol H2.Mặt khác hòa tan hoàn toàn 3,04g hỗn hợp X trong dung dịch H2SO4 đặc nóng thì thu được V(l) SO2 ở đktc (sản phẩm khử duy nhất).
đề là 0,05 h2..mới đúng ..có h2..thì tìm đk o-..rồi bảo toàn e là ra
1. Hòa tan hoàn toàn 6 gam kim loại hóa trị II vào m gam H2O thu được (m+5.7) gam dung dịch A. Xác định kim loại X.
2. Hòa tan hoàn toàn 1 kim loại X hóa trị II bằng dung dịch HCl 14.6% vừa đủ thu được 1 dung dịch muối có nồng độ phần trăm là 24.15 % . Xác định tên kim loại.
1/ PT : X + 2H2O -> X[OH]2 + H2
mol : \(\frac{6}{M_X}\) -> \(\frac{6}{M_X}\)
=> mH2 = \(\frac{12}{M_X}\) => mdd = m+6 - \(\frac{12}{M_X}\)
Ta có: m+5,7 = m+6 - \(\frac{12}{M_X}\)
<=> \(\frac{12}{M_X}\)= 0,3 => MX = 40 => X là Canxi [Ca]
2/ Dặt nHCl= a [a> 0] => mddHCl= 36,5a : 14,6 x 100= 250a
PT : X + 2HCL => XCl2 + H2
mol : a/2 a -> a/2 a/2
mH2 = a/2 x 2 = a ; mX = a/2 . MX
m XCl2= a/2 x [MX +71]
mdd XCL2= a/2 .MX + 250a - a = a/2 .MX +249a
Ta có :\(\frac{\frac{a}{2}\times M_X+\frac{71}{2}a}{M_X\times a:2+249a}\times100\%=24,15\%\)
<=> \(\frac{M_X+71}{M_X+498}=24,15\%\Leftrightarrow M_X=65\)=> X là kẽm [Zn]