tính thể tích hiđro và oxi(đktc) thu được khí điện phân 1,8g H2O

Những câu hỏi liên quan
Tính thể tích khí hiđro và oxi(đktc) cần tác dụng với nhau để tạo ra được 1,8g nước.
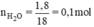
Phương trình phản ứng:
2H2 + O2 → 2H2O.
Đúng 0
Bình luận (0)
Bài 32: Điện phân hoàn toàn 3,6 gam nước ở trạng thái lỏng. Tính thể tích khí hiđro và khí oxi thu được ở đktc?
\(n_{H_2O}=\dfrac{3,6}{18}=0,2\left(mol\right)\\
pthh:2H_2O\underrightarrow{\text{đ}p}2H_2+O_2\)
0,2 0,2 0,1
=> \(\left\{{}\begin{matrix}V_{H_2}=0,2.22,4=4,48\left(L\right)\\V_{O_2}=0,1.22,4=2,24\left(L\right)\end{matrix}\right.\)
Đúng 2
Bình luận (0)
Đốt nóng hidro trong khí oxi người ta nhận thấy cứ 2 thể tích khí hidro kêt hợp với 1 thể tích oxi tạo thành nước. Sau phản ứng, người ta thu được 1,8g nước.Hãy tìm thể tích các khí hidro và oxi tham gia phản ứng ở đktc.
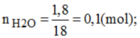
Theo phương trình hóa học: n H 2 = n H 2 O = 0,1(mol)
Đúng 0
Bình luận (0)
Cho 11,2 lít khí hiđro (đktc) tác dụng hết với khí oxi thu được nước . Tính thể tích khí oxi tham gia phản ứng (đktc). Tính khối lượng nước tạo thành.
nH2=11,2/22,4=0,5(mol)
2H2+O2->2H2O
0,5 0,25 0,5
V(O2)=0,25*22,4=5,6(lít)
mH2O=0,5*18=9(g)
Đúng 1
Bình luận (0)
Cho 4,48 lít khí hiđro tác dụng với khí oxi. Biết các thể tích khí đo ở đktc. Tính a/ số gam nước thu được b/ thể tích khí oxi cần dùng
Số mol của 4,48 lít H2:
\(n_{H_2}=\dfrac{V}{22,4}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PTHH:
\(2H_2+O_2\underrightarrow{t^o}2H_2O\)
tỉ lệ: 2 : 1 : 2
0,2-> 0,1 : 0,2( mol)
a/ số gam của 0,2 mol nước:
\(m_{H_2O}=n.M=0,2.=3,6\left(g\right)\)
b/ thể tích của 0,1 mol khí O2:
\(V_{O_2}=n.22,4=0,1.22,4=2,24\left(l\right)\)
Đúng 1
Bình luận (0)
Đốt cháy hoàn toàn hỗn hợp gồm CO và H2 cần phải dùng 3,36 lít khí oxi ở đktc và thu được 1,8g nước.
a) Tính thể tích mỗi chất trong hỗn hợp ban đầu
b) Tính khối lượng CO2 tạo thành
a)
\(n_{O_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
\(n_{H_2O}=\dfrac{1,8}{18}=0,1\left(mol\right)\)
PTHH: 2H2 + O2 --to--> 2H2O
0,1<-0,05<-------0,1
2CO + O2 --to--> 2CO2
0,2<--0,1-------->0,2
=> \(\left\{{}\begin{matrix}V_{H_2}=0,1.22,4=2,24\left(l\right)\\V_{CO}=0,2.22,4=4,48\left(l\right)\end{matrix}\right.\)
b) \(m_{CO_2}=0,2.44=8,8\left(g\right)\)
Đúng 3
Bình luận (0)
\(n_{O_2}=\dfrac{3,36}{22,4}=0,15mol\)
\(n_{H_2O}=\dfrac{1,8}{18}=0,1mol\)
\(2CO+O_2\rightarrow2CO_2\)
a 0,5a a
\(2H_2+O_2\rightarrow2H_2O\)
0,1 0,05 \(\leftarrow\) 0,1
\(\Sigma n_{O_2}=0,5a+0,05=0,15\)
\(\Rightarrow a=n_{O_2\left(CO\right)}=0,2mol\)
\(V_{CO}=2\cdot0,2\cdot22,4=8,96l\)
\(V_{H_2}=0,1\cdot22,4=2,24l\)
\(m_{CO_2}=0,2\cdot44=8,8g\)
Đúng 2
Bình luận (0)
đốt cháy hoàn toàn một hỗn hợp 20 hidrocacbon khác nhau thu được 8,8g co2 và 1,8g h2o thì số lít (đktc) khí oxi cần dùng là
\(n_{CO_2}=\dfrac{8,8}{44}=0,2\left(mol\right)\)
\(n_{H_2O}=\dfrac{1,8}{18}=0,1\left(mol\right)\)
Bảo toàn O: \(n_{O_2}=\dfrac{0,2.2+0,1.1}{2}=0,25\left(mol\right)\)
=> \(V_{O_2}=0,25.22,4=5,6\left(l\right)\)
Đúng 3
Bình luận (0)
1/ khử 48 gam đồng (II) Oxit bằng khí hiđro.hãy
tính số gam đồng kim loại thu được
tính thể tích khí hiđro (đktc) cần dùng
2/ tính số gam nước thu được khi cho 8,4 lít khí hiđro tác dụng với 2,8 lít khí oxi (các thể tích khí đo ở đktc)
1/ \(CuO+H_2-^{t^o}\rightarrow Cu+H_2O\)
\(n_{Cu}=n_{CuO}=\dfrac{48}{80}=0,6\left(mol\right)\)
=> \(m_{Cu}=0,6.64=38,4\left(g\right)\)
\(n_{H_2}=n_{CuO}=0,6\left(mol\right)\)
=> \(V_{H_2}=0,6.22,4=13,44\left(l\right)\)
Đúng 3
Bình luận (0)
2. \(2H_2+O_2-^{t^o}\rightarrow2H_2O\)
\(n_{H_2}=0,375;n_{O_2}=0,125\)
Lập tỉ lệ \(\dfrac{0,375}{2}>\dfrac{0,125}{1}\)
=> Sau phản ứng H2 dư, tính theo số mol O2
\(n_{H_2O}=2n_{O_2}=0,25\left(mol\right)\)
=> \(m_{H_2O}=0,25.18=4,5\left(g\right)\)
Đúng 3
Bình luận (0)
Cho 11,2g sắt tác dụng với dung dịch axit sunfuric loãng vừa đủ thu được sắt (ll) sunfat và khí hidro.
a) Tính thể tích khí hiđro sinh ra ở đktc .
b) Cần phải phân hủy bao nhiêu g thuốc tím để tạo đủ lượng oxi phản ứng với hết lượng khí hiđro sinh ra trong phản ứng trên ?
c) Nếu đốt cháy hoàn toàn bộ lượng sắt ở trên trong bình chứa 2,24 l khí oxi ở đktc thì sắt có cháy hết không ? Giải thích .
(Biết H1, O16, S32, Cu64, Fe56, K39, MN55)
Đọc tiếp
Cho 11,2g sắt tác dụng với dung dịch axit sunfuric loãng vừa đủ thu được sắt (ll) sunfat và khí hidro. a) Tính thể tích khí hiđro sinh ra ở đktc . b) Cần phải phân hủy bao nhiêu g thuốc tím để tạo đủ lượng oxi phản ứng với hết lượng khí hiđro sinh ra trong phản ứng trên ? c) Nếu đốt cháy hoàn toàn bộ lượng sắt ở trên trong bình chứa 2,24 l khí oxi ở đktc thì sắt có cháy hết không ? Giải thích . (Biết H=1, O=16, S=32, Cu=64, Fe=56, K=39, MN=55)
a)
\(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
PTHH: Fe + H2SO4 --> FeSO4 + H2
0,2----------------------->0,2
=> VH2 = 0,2.22,4 = 4,48 (l)
b)
PTHH: 2H2 + O2 --to--> 2H2O
0,2-->0,1
PTHH: 2KMnO4 --to--> K2MnO4+ MnO2 + O2
0,2<------------------------------0,1
=> \(m_{KMnO_4}=0,2.158=31,6\left(g\right)\)
c) \(n_{O_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
PTHH: 3Fe + 2O2 --to--> Fe3O4
Xét tỉ lệ: \(\dfrac{0,2}{3}>\dfrac{0,1}{2}\) => Fe dư
Đúng 1
Bình luận (0)
a.\(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\uparrow\)
0,2 0,2 ( mol )
\(V_{H_2}=0,2.22,4=4,48\left(l\right)\)
b.\(2H_2+O_2\rightarrow\left(t^o\right)2H_2O\)
0,2 0,1 ( mol )
\(2KMnO_4\rightarrow\left(t^o\right)K_2MnO_4+MnO_2+O_2\uparrow\)
0,2 0,1 ( mol )
\(m_{KMnO_4}=0,2.158=31,6\left(g\right)\)
c.\(n_{O_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
\(3Fe+2O_2\rightarrow\left(t^o\right)Fe_3O_4\)
Xét: \(\dfrac{0,2}{3}\) > \(\dfrac{0,1}{2}\) ( mol )
--> Sắt không cháy hết
Đúng 0
Bình luận (0)






















