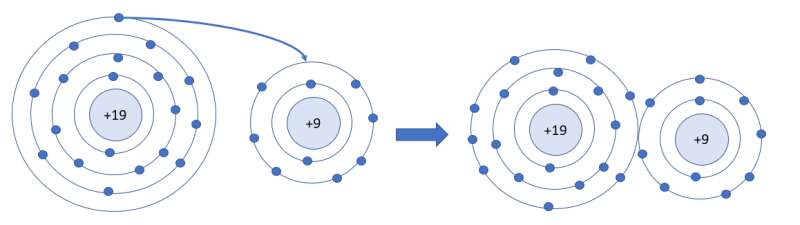
Số electron ở lớp ngoài cùng của nguyên tử K và F lần lượt là 1 và 7. Hãy cho biết khi K hết hợp với F để tạo thành phân tử potassium fluoride, nguyên tử K cho hay nhận bao nhiêu electron. Vẽ sơ đồ tạo thành liên kết trong phân tử potassium fluoride
Nguyên tử Ca có 2 electron ở lớp ngoài cùng. Hãy vẽ sơ đồ tạo thành liên kết khi nguyên tử Ca kết hợp với nguyên tử O tạo ra phân tử calcium oxide
- Ca có 2 electron ở lớp ngoài cùng (giống như nguyên tử Mg) => Dễ dàng cho đi 2 electron ở lớp ngoài cùng để tạo cấu hình electron bền vững của khí hiếm
- O có 6 electron ở lớp ngoài cùng => Dễ dàng nhận thêm 2 electron ở lớp ngoài cùng để tạo cấu hình electron bền vững của khí hiếm
Cái sơ đồ em vẽ vòng e của 2 nguyên tử dùng dấu + xong -> thành 2 vòng e các nguyên tử sát nhau
Đúng 0
Bình luận (0)
Trong những nhận xét dưới đây, nhận xét nào không đúng ?A. Nguyên tử nitơ có hai lớp electron và lớp ngoài cùng có ba electron.B. Số hiệu nguyên tử của nitơ bằng 7.C. Ba electron ở phân lớp 2p của nguyên tử nitơ có thể tạo được ba liên kết cộng hoá trị với các nguyên tử khác.D. Cấu hình electron của nguyên tử nitơ là
1
s
2
2
s
2
3
s
3
và nitơ là nguyên tố p.
Đọc tiếp
Trong những nhận xét dưới đây, nhận xét nào không đúng ?
A. Nguyên tử nitơ có hai lớp electron và lớp ngoài cùng có ba electron.
B. Số hiệu nguyên tử của nitơ bằng 7.
C. Ba electron ở phân lớp 2p của nguyên tử nitơ có thể tạo được ba liên kết cộng hoá trị với các nguyên tử khác.
D. Cấu hình electron của nguyên tử nitơ là 1 s 2 2 s 2 3 s 3 và nitơ là nguyên tố p.
vẽ sơ đồ cấu tạo nguyên tử nguyên tố O(Z=8),Mg(Z=17),Ca(Z=20).Cho biết số lớp electron và số electron lớp ngoài cùng mỗi loại nguyên tử
Phân lớp electron ngoài cùng của nguyên tử X,Y lần lượt là 3sa ; 3pb. Biết phân lớp 3s của X và Y hơn kém nhau 1 electron và Y tạo được hợp chất khí với Hidro có công thức H2Y. Nhận định nào sau đây là đúng : A. X tan trong nước tạo dung dịch làm đỏ quì tím B. Y tan trong nước làm quì tím hóa xanh C. Liên kết X và Y thuộc loại liên kết cộng hóa trị D. Số electron độc thân trong nguyên tử Y gấp 2 lần trong nguyên tử X
Đọc tiếp
Phân lớp electron ngoài cùng của nguyên tử X,Y lần lượt là 3sa ; 3pb. Biết phân lớp 3s của X và Y hơn kém nhau 1 electron và Y tạo được hợp chất khí với Hidro có công thức H2Y. Nhận định nào sau đây là đúng :
A. X tan trong nước tạo dung dịch làm đỏ quì tím
B. Y tan trong nước làm quì tím hóa xanh
C. Liên kết X và Y thuộc loại liên kết cộng hóa trị
D. Số electron độc thân trong nguyên tử Y gấp 2 lần trong nguyên tử X
Đáp án : D
Hợp chất của Y với H là H2Y => Y thuộc nhóm VIA ( 3s23p4) [ có 2e độc thân ]
Vì phân lớp 3s của X và Y hơn kém nhau 1e => X : 3s1 => X là kim loại kiềm (IA)
[ có 1 e độc thân
Đúng 0
Bình luận (0)
X, Y là những nguyên tố có điện tích hạt nhân lần lượt là 9, 19.Cấu hình electron lớp ngoài cùng của nguyên tử X, Y và liên kết trong hợp chất tạo thành từ X và Y là A.
2
s
2
2
p
5
,
4
s
1
và liên kết cộng hóa trị. B.
2
s
2
2
p...
Đọc tiếp
X, Y là những nguyên tố có điện tích hạt nhân lần lượt là 9, 19.
Cấu hình electron lớp ngoài cùng của nguyên tử X, Y và liên kết trong hợp chất tạo thành từ X và Y là
A. 2 s 2 2 p 5 , 4 s 1 và liên kết cộng hóa trị.
B. 2 s 2 2 p 3 , 3 s 2 3 p 1 và liên kết cộng hóa trị.
C. 3 s 2 3 p 5 , 4 s 1 và liên kết ion.
D. 2 s 2 2 p 5 , 4 s 1 và liên kết ion.
Chọn D
Cấu hình electron nguyên tử X: [He]2s22p5.
Cấu hình electron nguyên tử Y: [Ar]4s1
X là phi kim điển hình (nhóm VIIA) và Y là kim loại điển hình (nhóm IA) nên liên kết trong hợp chất tạo thành từ X và Y là liên kết ion.
Đúng 0
Bình luận (0)
X, Y là những nguyên tố có điện tích hạt nhân lần lượt là 12, 17. Cấu hình electron lớp ngoài cùng của nguyên tử X, Y và liên kết trong hợp chất tạo thành từ X và Y là
X: \(1s^22s^22p^63s^2\)
\(Y:1s^22s^22p^63s^23p^5\)
=> X cho 2e để đạt cấu hình bền vững, Y nhận 1e để đạt đến cấu hình bền vững
=> Hợp chất tạo bởi X,Y là XY2, liên kết ion
Đúng 2
Bình luận (0)
X, Y là những nguyên tố có điện tích hạt nhân lần lượt là 9, 19.Cấu hình electron lớp ngoài cùng của nguyên tử X, Y và liên kết trong hợp chất tạo thành từ X và Y là A. 2s22p5, 4s1 và liên kết cộng hóa trị. B. 2s22p3, 3s23p1 và liên kết cộng hóa trị. C. 3s23p1, 4s1 và liên kết ion. D. 2s22p5, 4s1 và liên kết ion.
Đọc tiếp
X, Y là những nguyên tố có điện tích hạt nhân lần lượt là 9, 19.Cấu hình electron lớp ngoài cùng của nguyên tử X, Y và liên kết trong hợp chất tạo thành từ X và Y là
A. 2s22p5, 4s1 và liên kết cộng hóa trị.
B. 2s22p3, 3s23p1 và liên kết cộng hóa trị.
C. 3s23p1, 4s1 và liên kết ion.
D. 2s22p5, 4s1 và liên kết ion.
Hãy dự đoán xu hướng nhường, nhận electron của mỗi nguyên tử trong từng cặp nguyên tử sau. Vẽ mô hình (hoặc viết số electron theo lớp) quá trình các nguyên tử nhường, nhận electron để tạo ion
a) K (Z = 19) và O (Z = 8).
b) Li (Z = 3) và F (Z = 9).
c) Mg (Z = 12) và P (Z = 15).
a)
- K (Z = 19): 1s22s22p63s23p64s1 => Có 1 electron ở lớp vỏ ngoài cùng => Xu hướng nhường 1 electron
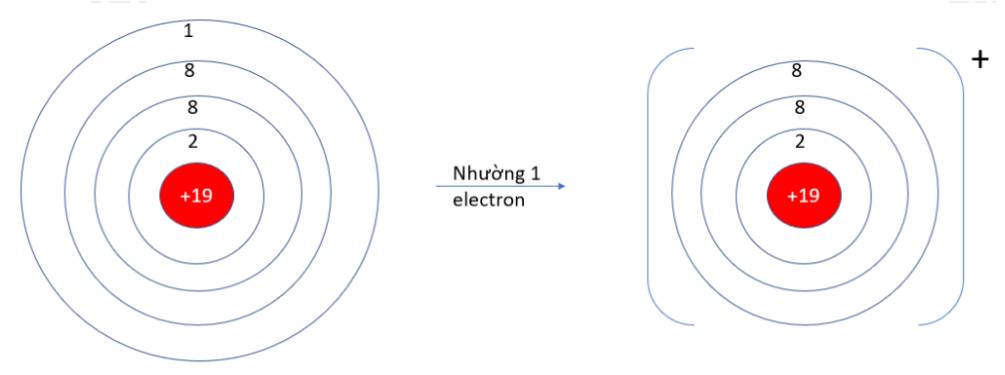
- O (Z = 8): 1s22s22p4 => Có 6 electron ở lớp vỏ ngoài cùng => Xu hướng nhận 2 electron

b)
- Li (Z = 3): 1s22s1 => Có 1 electron ở lớp vỏ ngoài cùng => Xu hướng nhường 1 electron
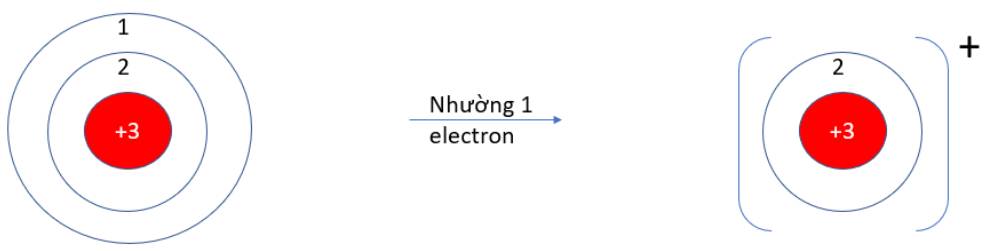
- F (Z = 9): 1s22s22p5 => Có 7 electron ở lớp vỏ ngoài cùng => Xu hướng nhận 1 electron
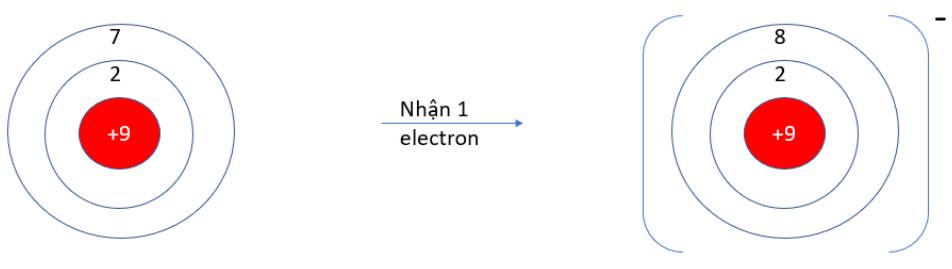
c)
- Mg (Z = 12): 1s22s22p63s2 => Có 2 electron ở lớp vỏ ngoài cùng => Xu hướng nhường 2 electron
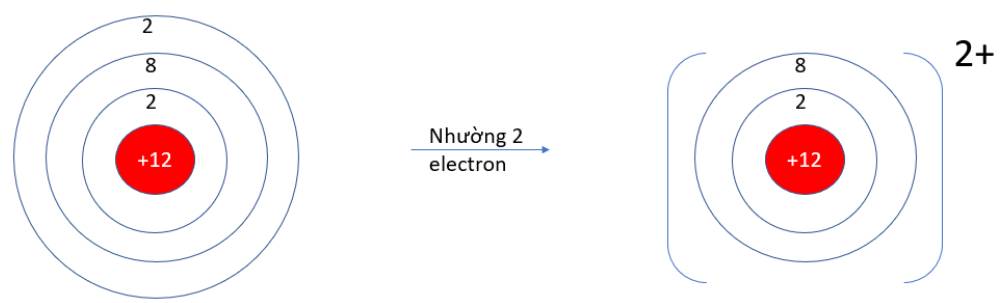
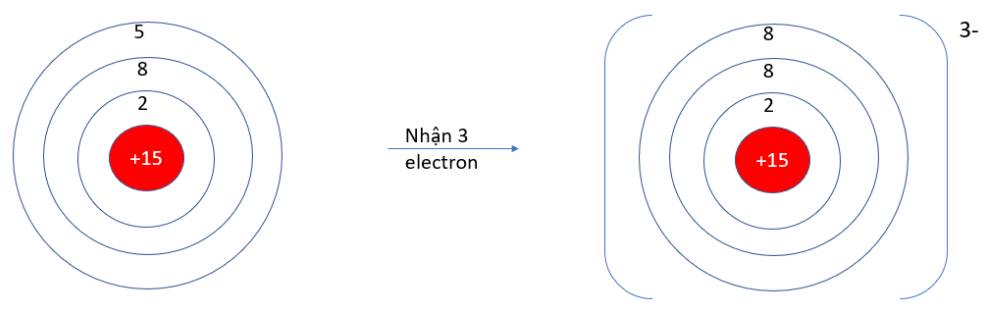
- P (Z = 15): 1s22s22p63s23p3 => Có 5 electron ở lớp vỏ ngoài cùng => Xu hướng nhận 3 electron
Đúng 0
Bình luận (0)
Vẽ sơ đồ tạo thành liên kết ion trong phân tử magnesium oxide?Biết Mg=12p;O=8p