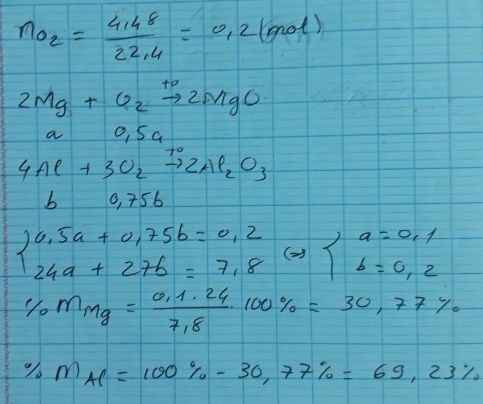Đốt cháy hỗn hợp bột Al và Mg cần 16,8 lít khí oxi (đktc). Biết lượng Al trong hỗn hợp là 13,5 gam . Tính thành phần phần trăm theo khối lượng của Mg trong hỗn hợp đó?

Những câu hỏi liên quan
Đốt cháy hỗn hợp bột Al và Mg cần 16,8 lít khí oxi (đktc). Biết lượng Al trong hỗn hợp là 13,5 gam . Tính thành phần phần trăm theo khối lượng của Mg trong hỗn hợp đó?
PTHH: \(4Al+3O_2\underrightarrow{t^o}2Al_2O_3\) (1)
\(2Mg+O_2\underrightarrow{t^o}2MgO\) (2)
Ta có: \(\left\{{}\begin{matrix}n_{O_2\left(1\right)}=\dfrac{3}{4}n_{Al}=\dfrac{3}{4}\cdot\dfrac{13,5}{27}=0,375\left(mol\right)\\n_{O_2\left(1\right)}+n_{O_2\left(2\right)}=\dfrac{16,8}{22,4}=0,75\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow n_{O_2\left(2\right)}=0,375\left(mol\right)\) \(\Rightarrow n_{Mg}=0,75\left(mol\right)\)
\(\Rightarrow\%m_{Mg}=\dfrac{0,75\cdot24}{0,75\cdot24+13,5}\cdot100\%\approx57,14\%\)
Đúng 1
Bình luận (0)
đốt cháy hoàn toàn 5,1 gam hỗn hợp X gồm Mg và Al cần dùng vừa đủ 2,8 lít khí oxi ở đktc. tính phần trăm khối lượng Mg trong X
\(2Mg+O_2\xrightarrow{t^o}2MgO\\ 4Al+3O_2\xrightarrow{t^o}2Al_2O_3\\ \Rightarrow \begin{cases} 24.n_{Mg}+27.n_{Al}=5,1\\ 0,5.n_{Mg}+0,75.n_{Al}=n_{O_2}=\dfrac{2,8}{22,4}=0,125 \end{cases}\\ \Rightarrow \begin{cases} n_{Mg}=0,1(mol)\\ n_{Al_2O_3}=0,1(mol) \end{cases}\\ \Rightarrow \%m_{Mg}=\dfrac{0,1.24}{5,1}.100\%\approx 47,06\%\)
Đúng 1
Bình luận (0)
1. Đốt cháy hết 2,3 g natri trong khí oxi thu được m g chất rắn.a) Tính thể tích oxi (ở đktc) cần thiết để đốt cháy lượng natri trên.b) Tính m.72. Đốt cháy hỗn hợp bột Mg và bột Al cần 8,96 lít O2 ở đktc. Biết khối lượng Al là 2,7 gam. Tính thành phần phần trăm của hai kim loại trong hỗn hợp trên.3. Để đốt cháy hoàn toàn 3,9 g hỗn hợp bột Mg và bột Al cần dùng vừa đủ 2,24 lít khí O2 (ở đktc). Tính thành phần phần trăm của hai kim loại trong hỗn hợp trên.4. Đốt cháy 2,9 g hỗn hợp X gồm CH4 và C2...
Đọc tiếp
1. Đốt cháy hết 2,3 g natri trong khí oxi thu được m g chất rắn.
a) Tính thể tích oxi (ở đktc) cần thiết để đốt cháy lượng natri trên.
b) Tính m.7
2. Đốt cháy hỗn hợp bột Mg và bột Al cần 8,96 lít O2 ở đktc. Biết khối lượng Al là 2,7 gam. Tính thành phần phần trăm của hai kim loại trong hỗn hợp trên.
3. Để đốt cháy hoàn toàn 3,9 g hỗn hợp bột Mg và bột Al cần dùng vừa đủ 2,24 lít khí O2 (ở đktc). Tính thành phần phần trăm của hai kim loại trong hỗn hợp trên.
4. Đốt cháy 2,9 g hỗn hợp X gồm CH4 và C2H2 bằng V lít khí O2(ở đktc) thu được 4,48 lít CO2(ở đktc).
a) Viết các phản ứng hoá học xảy ra.
b) Tính V.
c) Tính phần trăm về thể tích mỗi khí trong X.
5:Hoàn thành thông tin còn thiếu trong bảng sau:
TT | Công thức hoá học | Tên gọi | Phân loại | |
Oxit axit | Oxit bazơ | |||
1 |
| Lưu huỳnh đioxit |
|
|
2 | P2O3 |
| x |
|
3 | K2O |
|
|
|
4 |
| Đinitơ pentaoxit |
|
|
5 |
| Magie oxit |
|
|
6 |
| Cacbon đioxit |
|
|
7 |
| Đồng (I) oxit |
| x |
8 | Na2O |
|
|
|
6: Chất A là hợp chất khí của lưu huỳnh với oxi, có tỉ khối so với hiđro là 32 trong đó oxi chiếm 50% về khối lượng. Xác định công thức của A.
tui cần gấp giải đc bài nào thì giải
Bài 1 :
\(n_{Na}=\dfrac{m}{M}=0,1\left(mol\right)\)
\(4Na+O_2\rightarrow2Na_2O\)
..0,1....0,025....0,05.......
a, \(V_{O_2}=n.22,4=0,56\left(l\right)\)
b, \(m=m_{Na_2o}=n.M=3,1\left(g\right)\)
Bài 2 :
\(n_{Al}=\dfrac{m}{M}=0,1\left(mol\right)\)
\(4Al+3O_2\rightarrow2Al_2O_3\)
..0,1...0,075...
\(\Rightarrow n_{O_2}=0,075\left(mol\right)\)
Mà : \(\Sigma n_{O_2}=\dfrac{V}{22,4}=0,4\left(mol\right)\)
\(\Rightarrow n_{O_2\left(Mg\right)}=0,4-0,075=0,325\left(mol\right)\)
\(2Mg+O_2\rightarrow2MgO\)
.0,65.....0,325........
\(\Rightarrow m_{Mg}=15,6\left(g\right)\)
\(\Rightarrow m_{hh}=2,7+15,6=18,3\left(g\right)\)
\(\Rightarrow\left\{{}\begin{matrix}\%Al=~14,75\\\%Mg=~85,25\end{matrix}\right.\) %
Bài 3 :
- Gọi số mol Al và Mg lần lượt là x , y
\(4Al+3O_2\rightarrow2Al_2O_3\)
..x....0,75x
\(2Mg+O_2\rightarrow2MgO\)
..y........0,5y...........
Có : \(n_{O_2}=0,75x+0,5y=\dfrac{V}{22,4}=0,1\left(mol\right)\left(I\right)\)
Lại có : \(m_{hh}=m_{Al}+m_{Mg}=27x+24y=3,9\left(II\right)\)
- Giair ( i ) và ( ii ) ta được : \(\left\{{}\begin{matrix}x=0,1\\y=0,05\end{matrix}\right.\) ( mol )
\(\Rightarrow\left\{{}\begin{matrix}\%Al=~69,23\\\%Mg=~30,77\end{matrix}\right.\) %
Vậy ...
Đúng 3
Bình luận (0)
Đốt cháy hỗn hợp bột của kim loại magie và nhôm cần 33,6 lít khí oxi ở đktc. Biết khối lượng nhôm trong hỗn hợp là 2,7 gam. Hãy tính thành phần phần trăm khối lượng của hai kim loại trong hỗn hợp trên.
PTHH: \(2Mg+O_2\underrightarrow{t^o}2MgO\) (1)
\(4Al+3O_2\underrightarrow{t^o}2Al_2O_3\) (2)
Ta có: \(\left\{{}\begin{matrix}\Sigma n_{O_2}=\dfrac{33,6}{22,4}=1,5\left(mol\right)\\n_{Al}=\dfrac{2,7}{27}=0,1\left(mol\right)\Rightarrow n_{O_2\left(2\right)}=0,075\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow n_{O_2\left(1\right)}=1,425\left(mol\right)\) \(\Rightarrow n_{Mg}=2,85\left(mol\right)\)
\(\Rightarrow\%m_{Mg}=\dfrac{2,85\cdot24}{2,85\cdot24+2,7}\cdot100\%\approx96,2\%\)
\(\Rightarrow\%m_{Al}=3,8\%\)
Đúng 1
Bình luận (0)
\(n_{O_2} =\dfrac{33,6}{22,4} = 1,5(mol)\\ n_{Al} = \dfrac{2,7}{27} = 0,1(mol)\\ 2Mg + O_2 \xrightarrow{t^o} 2MgO\\ 4Al + 3O_2 \xrightarrow{t^o} 2Al_2O_3\\ n_{O_2} = \dfrac{1}{2}n_{Mg} + \dfrac{3}{4}n_{Al}\\ \Rightarrow n_{Mg} = 2,85(mol)\)
Vậy :
\(\%m_{Mg} = \dfrac{2,85.24}{2,85.24 + 2,7}.100\% = 96,2\%\\ \%m_{Al} = 100\% - 96,2\% = 3,8\%\)
Đúng 2
Bình luận (0)
Đốt cháy hỗn hợp bột Al và bột Mg,trong đó bột Al là 2,7g cần tổng cộng 3,7185 lít khí O2 (đkc). Hỏi thành phần phần trăm mỗi kim loại trong hỗn hợp ban đầu ?
PT: \(4Al+3O_2\underrightarrow{t^o}2Al_2O_3\)
\(2Mg+O_2\underrightarrow{t^o}2MgO\)
Ta có: \(n_{Al}=\dfrac{2,7}{27}=0,1\left(mol\right)\)
\(n_{O_2}=\dfrac{3,7185}{24,79}=0,15\left(mol\right)\)
Theo PT: \(n_{O_2}=\dfrac{3}{4}n_{Al}+\dfrac{1}{2}n_{Mg}\) \(\Rightarrow n_{Mg}=0,15\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Al}=\dfrac{2,7}{2,7+0,15.24}.100\%\approx42,86\%\\\%m_{Mg}\approx57,14\%\end{matrix}\right.\)
Đúng 1
Bình luận (0)
đốt cháy 15,6 gam hỗn hợp gồm Al Mg cần dùng vừa hết 8,9 6 lít khí oxi ở đktc. Tính phần trăm khối lượng các kim loại trong hỗn hợp ban đầu. tính khối lượng, số phân tử sinh ra
4Al + 3O2 => 2Al2O3
2Mg + O2 => 2MgO
giải hệ 27x+24y= 15,6
0,75x+0,5y= 0,4
=> x= 0,4 ;y= 0,2
=> mAl = 0,4.27 = 10,8(g)
%Al = \(\frac{10,8}{15,6}.100\%=69,23\%\)
=> %Mg = 100%- 69,23% = 30,77%
Đúng 1
Bình luận (0)
Đốt cháy hoàn toàn hỗn hợp gồm Al , Mg cần 16,8 lít khí oxi , trong đó khối lượng của Al là 5,4g a. Lập các PTHH b. Tính % về khối lượng của 2 kim loại Al , Mg Giúp tớ với plssss 🌥
`4Al + 3O_2` $\xrightarrow{t^o}$ `2Al_2 O_3`
`0,2` `0,15` `(mol)`
`2Mg + O_2` $\xrightarrow{t^o}$ `2MgO`
`1,5` `0,75` `(mol)`
`n_[Al]=[5,4]/27=0,2(mol)`
`n_[O_2]=[16,8]/[22,4]=0,75(mol)`
`=>m_[hh]=0,2.27+1,5.24=41,4(g)`
`=>%m_[Al]=[5,4]/[41,4].100~~13,04%`
`=>%m_[Mg]~~100-13,04~~86,96%`
Đúng 1
Bình luận (0)
1.Đốt cháy hỗn hợp bột Fe và Mg trong đó khối lượng Mg là 0,48g cần dùng hết 672ml oxi ở đktc.a)Tính khối lượng hỗn hợp ban đầub)Tính thành phần phần trăm theo khối lượng mỗi kim loại trong hỗn hợp2.Cho dòng khí CO dư đi qua hỗn hợp 2 oxit CuO và Fe2O3 nung nóng thu được 29,6g hỗn hợp 2 kim loại trong đó Fe nhiều hơn Cu 4g.Tính thể tích khí CO cần dùng ở đktc
Đọc tiếp
1.Đốt cháy hỗn hợp bột Fe và Mg trong đó khối lượng Mg là 0,48g cần dùng hết 672ml oxi ở đktc.
a)Tính khối lượng hỗn hợp ban đầu
b)Tính thành phần phần trăm theo khối lượng mỗi kim loại trong hỗn hợp
2.Cho dòng khí CO dư đi qua hỗn hợp 2 oxit CuO và Fe2O3 nung nóng thu được 29,6g hỗn hợp 2 kim loại trong đó Fe nhiều hơn Cu 4g.
Tính thể tích khí CO cần dùng ở đktc
Đem oxi hóa hoàn toàn 7,8 gam hỗn hợp gồm Mg và Al cần vừa đủ 4,48 lít O2 (đktc). Tính thành phần trăm về khối lượng của mỗi chất có trong hỗn hợp ban đầu
\(n_{O_2}=0,2\left(mol\right)\)
PTHH:
\(2Mg+O_2\rightarrow2MgO\)
\(4Al+3O_2\rightarrow2Al_2O_3\)
\(\Rightarrow n_{O_2}=\dfrac{1}{2}n_{Mg}+\dfrac{3}{4}n_{Al}\Leftrightarrow\dfrac{1}{2}n_{Mg}+\dfrac{3}{4}n_{Al}=0,2\left(1\right)\)
Mặt khác: \(24n_{Mg}+27n_{Al}=7,8\left(2\right)\)
Giải hệ hai phương trình (1) và (2) ta được:
\(\left\{{}\begin{matrix}n_{Mg}=0,1\left(mol\right)\\n_{Al}=0,2\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Mg}=\dfrac{0,1.24}{7,8}.100\%=30,77\%\\\%m_{Al}=\dfrac{0,2.27}{7,8}.100\%=69,23\%\end{matrix}\right.\)
Đúng 2
Bình luận (0)