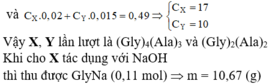Đốt cháy hoàn toàn m gam nhôm cần dùng 13,44 lít khí oxi (đktc) thu được m1 gam oxit. Tính m và m1

Những câu hỏi liên quan
đốt cháy hoàn toàn 6,5 gam kẽm cần dùng hết V lít khí oxi ở đktc và thu đc m1 gam kẽm oxit. Tính gt của V và m1?(Zn=65,O=16)
\(n_{Zn}=\dfrac{6.5}{65}=0.1\left(mol\right)\)
\(2Zn+O_2\underrightarrow{^{^{t^0}}}2ZnO\)
\(0.1.......0.05.......0.1\)
\(V_{O_2}=0.05\cdot22.4=1.12\left(l\right)\)
\(m_{ZnO}=0.1\cdot81=8.1\left(g\right)\)
Đúng 1
Bình luận (0)
Đốt cháy hoàn toàn m1 gam khí ãetilen(C2H2) cần V lít khí oxi(đktc) thu được 11,2 lít khí Co2(đktc) và m2 gam H2O. Tính m1+m2 và V
C2H2 + \(\frac{5}{2}\)O2 => (to) 2CO2 + H2O
0.25 0.625 0.5 0.25 (mol)
nCO2 = V/22.4 = 11.2/22.4 = 0.5 (mol);
m1 = n.M = 0.25 x 26 = 6.5 (g);
m2 = n.M = 0.25 x 18 = 4.5 (g);
m1 + m2 = 6.5 + 4.5 = 11 (g);
V = VO2 = n.22.4 = 0.625x22.4=14(l)
Đúng 0
Bình luận (0)
Đốt cháy hoàn toàn m1 gam khí etilen(C2H4) cần 7,84 lít khí oxi (đktc) thu được m2 lít khí CO2(đktc) và m3 gam H2O. Tính m1+m2+m3
Đốt cháy hoàn toàn 9,2g một hợp chất hưũ cơ X bằng 13,44 lít khí oxi ( đktc) vừa đủ. Sau pư thu đc m1 gam CO2 và m2 gam H2O . Biết m1:m2 = 44:27. Công thức đơn giản nhất cua X là?
Xem chi tiết
X + O2 → CO2 + H2O
Gọi số mol CO2 và H2O lần lượt là x và y mol
=> mCO2 = 44x gam và mH2O = 18y gam
Áp dụng ĐLBT khối lượng ta có : mX + mO2 = mCO2 + mH2O
=> 9,2 + \(\dfrac{13,44.32}{22,4}\)= 44x + 18y (1)
Mà mCO2 : mH2O = 44:27
=> 44x.27 = 18y.44 <=> 1188x - 792y = 0 (2)
Giải hệ pt từ (1) và (2) ta được x = 0,4 và y = 0,6
=> nC = nCO2 = 0,4 mol
nH = 2nH2O = 0,6.2 = 1,2 mol
=> mC + mH = 0,4.12 + 1,2.1 = 6 gam < mX
=> Trong X ngoài C và H còn có O và mO = 9,2 - 6 = 3,2 gam.
<=> nO = 3,2:16 = 0,2 mol
Gọi CTĐGN của X là CxHyOz
x : y : z = nC : nH : nO = 0,4 : 1,2 : 0,2 = 2 : 6 : 1
=> CTĐGN của X là C2H6O
Đúng 0
Bình luận (0)
Đốt cháy hoàn toàn 10,8 gam nhôm trong 6,72 lít khí oxi thu được m gam nhôm oxit?
Xem chi tiết
\(n_{O_2}=\dfrac{V}{22,4}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\\ m_{O_2}=n.M=0,3.32=9,6\left(g\right)\\ PTHH:4Al+3O_2\underrightarrow{t^o}2Al_2O_3\)
Theo định luật bảo toàn khối lượng, ta có:
\(m_{Al}+m_{O_2}=m_{Al_2O_3}\\ \rightarrow m_{Al_2O_3}=10,8+9,6=20,4\left(g\right)\)
Đúng 2
Bình luận (0)
1.Người ta dùng 13,44 lít 02(đktc) ddeer đốt cháy 1 lượng nhômA/Tính khối lượng nhôm cần phản ứngB/tính khối lượng nhôm oxit tạo thành (AL2O3)C/cần dùng bao nhiêu gam kalipemanganat (KMnO4) để thu được lượng oxi trên2.người ta dùng 28 lít không khí (đktc) để đốt cháy 1 lượng PhotphoA/tính khối lượng photpho cần phản ứngB/tính khối lượng đi photphopentaoxit tạo thành (P2O5)C/cần dùng bao nhiêu gam kaliclorat (KCLO2) để thu được lượng oxi trong không khí ở trên3.nung 200 gam đá vôi chứa 90% CaCO3A...
Đọc tiếp
1.Người ta dùng 13,44 lít 02(đktc) ddeer đốt cháy 1 lượng nhôm
A/Tính khối lượng nhôm cần phản ứng
B/tính khối lượng nhôm oxit tạo thành (AL2O3)
C/cần dùng bao nhiêu gam kalipemanganat (KMnO4) để thu được lượng oxi trên
2.người ta dùng 28 lít không khí (đktc) để đốt cháy 1 lượng Photpho
A/tính khối lượng photpho cần phản ứng
B/tính khối lượng đi photphopentaoxit tạo thành (P2O5)
C/cần dùng bao nhiêu gam kaliclorat (KCLO2) để thu được lượng oxi trong không khí ở trên
3.nung 200 gam đá vôi chứa 90% CaCO3
A/tính khối lượng canxi oxi thu được
B/tính thể tích khí cacbonic thu được ở Đktc
4.cho 80g đất đèn vào nước thì thu được bao nhiêu gam canxihiđroxit (Ca(OH)2 và bao nhiêu lít khí axetilen (đktc) (C2H2) biết trong đất đèn 80% canxi cacbua (CaC2)
giúp mình với mn ơi mình cảm ơn nhiều lắm
\(\)1.
\(n_{O_2}=\dfrac{13.44}{22.4}=0.6\left(mol\right)\)
\(4Al+3O_2\underrightarrow{^{^{t^0}}}2Al_2O_3\)
\(0.8........0.6..........0.4\)
\(m_{Al}=0.8\cdot27=21.6\left(g\right)\)
\(m_{Al_2O_3}=0.4\cdot102=40.8\left(g\right)\)
\(2KMnO_4\underrightarrow{^{^{t^0}}}K_2MnO_4+MnO_2+O_2\)
\(1.2..................................................0.6\)
\(m_{KMnO_4}=1.2\cdot158=189.6\left(g\right)\)
Đúng 3
Bình luận (0)
2.
\(n_{O_2}=\dfrac{28}{22.4}=1.25\left(mol\right)\)
\(4P+5O_2\underrightarrow{^{^{t^0}}}2P_2O_5\)
\(1......1.25........0.5\)
\(m_P=1\cdot31=31\left(g\right)\)
\(m_{P_2O_5}=0.5\cdot142=71\left(g\right)\)
\(2KClO_3\underrightarrow{^{^{t^0}}}2KCl+3O_2\)
\(\dfrac{5}{6}................1.25\)
\(m_{KClO_3}=\dfrac{5}{6}\cdot122.5=102.083\left(g\right)\)
Đúng 3
Bình luận (2)
3)
$m_{CaCO_3} = 200.90\% = 180(gam)$
$CaCO_3 \xrightarrow{t^o} CaO + CO_2$
$n_{CO_2} = n_{CaO} = \dfrac{180}{100} = = 1,8(mol)$
$m_{CaO} = 1,8.56 = 100,8(gam)$
$V_{CO_2} = 1,8.22,4 = 40,32(lít)$
4)
$CaC_2 + 2H_2O \to Ca(OH)_2 + C_2H_2$
$m_{CaC_2} = 80.80\% = 64(gam)$
$n_{Ca(OH)_2} = n_{C_2H_2} = n_{CaC_2} = \dfrac{64}{64} = 1(mol)$
$m_{Ca(OH)_2} = 1,74 = 74(gam)$
$V_{C_2H_2} = 1.22,4 = 22,4(lít)$
Đúng 4
Bình luận (1)
Xem thêm câu trả lời
Hỗn hợp P gồm hai peptit mạch hở: X (CnHmN7O8) và Y (CxHyN4O5). Đốt cháy hoàn toàn 13,29 gam hỗn hợp P cần dùng vừa đủ 13,104 lít khí O2 (đktc) thu được khí CO2, H2O và 2,24 lít khí N2. Thủy phân hoàn toàn 13,29 gam P trong dung dịch NaOH dư thu được m1 gam muối của glyxin và m2 gam muối của alanin. Giá trị của m1 là A. 10,67 B. 10,44 C. 8,73 D. 12,61
Đọc tiếp
Hỗn hợp P gồm hai peptit mạch hở: X (CnHmN7O8) và Y (CxHyN4O5). Đốt cháy hoàn toàn 13,29 gam hỗn hợp P cần dùng vừa đủ 13,104 lít khí O2 (đktc) thu được khí CO2, H2O và 2,24 lít khí N2. Thủy phân hoàn toàn 13,29 gam P trong dung dịch NaOH dư thu được m1 gam muối của glyxin và m2 gam muối của alanin. Giá trị của m1 là
A. 10,67
B. 10,44
C. 8,73
D. 12,61
Hỗn hợp P gồm hai peptit mạch hở: X (CnHmN7O8) và Y (CxHyN4O5). Đốt cháy hoàn toàn 13,29 gam hỗn hợp P cần dùng vừa đủ 13,104 lít khí O2 (đktc) thu được khí CO2, H2O và 2,24 lít khí N2. Thủy phân hoàn toàn 13,29 gam P trong dung dịch NaOH dư thu được m1 gam muối của glyxin và m2 gam muối của alanin. Giá trị của m1 là A. 10,67 B. 10,44 C. 8,73 D. 12,61
Đọc tiếp
Hỗn hợp P gồm hai peptit mạch hở: X (CnHmN7O8) và Y (CxHyN4O5). Đốt cháy hoàn toàn 13,29 gam hỗn hợp P cần dùng vừa đủ 13,104 lít khí O2 (đktc) thu được khí CO2, H2O và 2,24 lít khí N2. Thủy phân hoàn toàn 13,29 gam P trong dung dịch NaOH dư thu được m1 gam muối của glyxin và m2 gam muối của alanin. Giá trị của m1 là
A. 10,67
B. 10,44
C. 8,73
D. 12,61
Đốt cháy hoàn toàn nhôm trong bình đựng 6,72 lít khí oxi (đktc) thu được nhôm oxit. Tính khối lượng nhôm cần dùng:
Xem chi tiết
Ta có: n\(O_2\)=\(\dfrac{6.72}{22.4}\)=0.3 (mol)
PTHH: 4Al + 3O2 ______> 2Al2O3 (1)
Ta có: theo (1): nAl =\(\dfrac{4}{3}n_{O_2}\)=\(\dfrac{4}{3}0.3=0.4\left(mol\right)\)
=> mAl = 0.4 . 27=10.8(g)
Đúng 1
Bình luận (0)
PTHH: 4Al+3O2->to 2Al2O3
4 3 2 (mol)
0,3 (mol)
nO2= V/22,4=6,72/22,4=0,3 (mol)
nAl= nO2.4/3=0,3.4/3=0.4 (mol)
mAl=n.M=0,4.27=10,8 (g)
Đúng 0
Bình luận (0)
Em chú ý lần sau môn Hóa đăng ở box hóa nha!
Đúng 0
Bình luận (0)
Đốt cháy hoàn toàn 9,2g hỗn hợp gồm CH3OH , C2H5OH , C3H7OH , C4H9OH cần dùng vừa đủ 13,44 lít khí oxi(đktc) . Sau pư thu đc V lít CO2 (đktc) và m gam H2O. Giá trị V và m lần lượt là?
Đặt \(\left\{{}\begin{matrix}n_{CO_2}=a\left(mol\right)\\n_{H_2O}=b\left(mol\right)\end{matrix}\right.\)
Ta thấy các chất đều có công thức CnH2n+2O \(\Rightarrow n_{O\left(hỗnhợp\right)}=n_{H_2O}-n_{CO_2}\)
\(\Rightarrow n_{O\left(ancol\right)}=b-a\)
Ta có: \(m_{hh}=m_C+m_H+m_O=9,2\left(g\right)\) \(\Rightarrow a+2b+16\left(b-a\right)=9,2\) (1)
Mặt khác: \(n_{O_2}=\dfrac{13,44}{22,4}=0,6\left(mol\right)\)
Bảo toàn oxi: \(\left(b-a\right)+2\cdot0,6=2a+b\) (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}a=n_{CO_2}=0,4\left(mol\right)\\b=n_{H_2O}=\dfrac{38}{45}\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}V_{CO_2}=0,4\cdot22,4=8,96\left(l\right)\\m_{H_2O}=15,2\left(g\right)\end{matrix}\right.\)
Đúng 2
Bình luận (1)