Nhúng 1 thanh kẽm vào dd Fe(NO3)2 2M sau 1 thời gian thấy khối lượng kẽm giảm 4,5 gam
tính
a) m kẽm đã dùng
b)Vdd Fe(NO3)2
c)C% dd thu được (D Fe2+=1,12(g/mol))
Ngâm 1 lá kẽm trong 500ml dung dịch pb(no3)2 nồng độ 2M. Sau 1 thời gian lấy lá kẽm ra rửa cẩn thận làm khô, cân lại thì thấy nặng hơn so vs ban đầu 1,42g.
a) Hãy tính khối lượng chì bám vào lá kẽm.
b) nồng độ mol của dd sau khi lấy lá kẽm ra.
PTHH: Zn + Pb(NO3)2 → Zn(NO3)2 + Pb
(Gọi số mol của Zn là a => Số mol của Pb là a)
Sau 1 thời gian lấy lá kẽm ra thấy khối lượng tăng 1,42 gam = Khối lượng Pb sinh ra bám vào lá kẽm trừ đi khối lượng Zn phản ứng.
<=> 207a - 65a = 1,42
<=> a = 0,01 (mol)
a) Khối lượng chì bám vào kẽm là: 207a = 2,07(g)
b) Đổi: 500 ml = 0,5 l
Số mol của dung dịch Pb(NO3)2 là: 0,5 . 2 = 1 (mol)
So sánh: 0,01 < 1
=> Dung dịch Pb(NO3)2 dư , tính theo Zn
Số mol của Zn(NO3)2 là: 0,01 . 1 = 0,01 (mol)
Nồng độ mol của dung dịch sau khi lấy lá kẽm ra là:
CM = n / V = 0,01 : 0,5 = 0,02M
( Vì thể tích dung dịch k thay đổi đáng kể nên sau phản ứng và lấy lá kẽm ra thì thể tích dung dịch vẫn là 500 ml)
PTHH: Zn + Pb(NO3)2 → Zn(NO3)2 + Pb
(Gọi số mol của Zn là a => Số mol của Pb là a)
Sau 1 thời gian lấy lá kẽm ra thấy khối lượng tăng 1,42 gam = Khối lượng Pb sinh ra bám vào lá kẽm trừ đi khối lượng Zn phản ứng.
<=> 207a - 65a = 1,42
<=> a = 0,01 (mol)
a) Khối lượng chì bám vào kẽm là: 207a = 2,07(g)
b) Đổi: 500 ml = 0,5 l
Số mol của dung dịch Pb(NO3)2 là: 0,5 . 2 = 1 (mol)
So sánh: 0,01 < 1
=> Dung dịch Pb(NO3)2 dư , tính theo Zn
Số mol của Zn(NO3)2 là: 0,01 . 1 = 0,01 (mol)
Nồng độ mol của dung dịch sau khi lấy lá kẽm ra là:
CM = n / V = 0,01 : 0,5 = 0,02M
( Vì thể tích dung dịch k thay đổi đáng kể nên sau phản ứng và lấy lá kẽm ra thì thể tích dung dịch vẫn là 500 ml)
chúc bạn học tốt và nhớ tích đúng cho mình
PT: \(Zn+2AgNO_3\rightarrow Zn\left(NO_3\right)_2+2Ag\)
_____x_______2x__________x______2x (mol)
Ta có: m thanh kẽm tăng = mAg - mZn
⇒ 19,775 - 16 = 108.2x - 65x
⇒ x = 0,025 (mol)
a, mZn (pư) = 0,025.65 = 1,625 (g)
mAg = 0,025.2.108 = 5,4 (g)
b, Ta có: m dd AgNO3 = 80.1,1 = 88 (g)
\(\Rightarrow m_{AgNO_3}=88.10\%=8,8\left(g\right)\Rightarrow n_{AgNO_3}=\dfrac{8,8}{170}=\dfrac{22}{425}\left(mol\right)\)
\(\Rightarrow n_{AgNO_3\left(dư\right)}=\dfrac{22}{425}-0,025.2=\dfrac{3}{1700}\left(mol\right)\)
Có: m dd sau pư = 1,625 + 88 - 5,4 = 84,225 (g)
\(\Rightarrow\left\{{}\begin{matrix}C\%_{AgNO_3}=\dfrac{\dfrac{3}{1700}.170}{84,225}.100\%\approx0,36\%\\C\%_{Zn\left(NO_3\right)_2}=\dfrac{0,025.189}{84,225}.100\%\approx5,61\%\end{matrix}\right.\)
Nhiệt phân hoàn toàn 20g hỗn hợp MgCO3 và CuCO3 thì thu được m gam hỗn hợp oxít. Thu toàn bộ khí tạo thành cho hấp thụ hết vào 280 ml dd NaOH 1M thì thu được 18,56g hỗn hợp 2 muối
a. Tính khối lượng mỗi muối trong hỗn hợp ban đầu.
b. Hòa tan m gam hỗn hợp oxít trên vào 200 ml dd HCl( vừa đủ ) thì thu được dd X. Nhúng một thanh kẽm vào dung dịchX, sau một thời gian lấy thanh kẽm ra thu được dd Y và khối lượng thanh kẽm giảm 0,06g. Tính nồng độ mol của dd HCl và khối lượng các muối trong dd Y.
bài này bạn gọi ẩn xong giải hệ là ra
Nhúng 1 thanh kẽm có khối lượng 10g vào 200ml dd CuSO4 1M. Sau 1 t/g lấy thanh kẽm ra cân lại thấy khối lượng giảm 1% so với ban đầu và 1 dd. Tính khối lượng đồng thu được ?
Giúp mình với, mình rốt hóa lắm..!
nCuSO4 = 0.2*1=0.2mol
pt: Zn + CuSO4 --> ZnSO4 + Cu
0.2 0.2
=>mZn= 0.2*65=13g
Khối lương lá kim loại giảm xuống x% so với trước khi nhúng ta có: mtan - mbám= mban đầu *\(\frac{x\%}{100}\)
theo đề bài ta có: mCu bám = mZn tan - mZn ban đầu *\(\frac{x\%}{100}\)
= 13 -(\(10\cdot\frac{1}{100}\) )=12.9g
vậy khối lượng thu được là 12.9g
Lưu ý: dòng anh bôi đen là quan trọng cần ghi nhớ để làm bài, ngoài ra còn các công thức khác,em lên mạng tìm thêm hoặc liên lạc với anh để lấy nha
Chúc em học tốt !!!!!:))
Điện phân dd Cu(NO3)2 điện cực trơ, với cường độ dòng điện 3A, thu được dd X chứa hai chất tan có cùng nồng độ mol. Nhúng một thanh Fe vào dd X đến khi phản ứng xảy ra hoàn toàn, thu được khí NO là sản phẩm khử duy nhất, rút thành Fe ra cân lại thấy khối lượng thanh Fe giảm 1,56 gam so với ban đầu. Thời gian điện phân là
A. 3860 giây.
B. 7720 giây.
C. 5790 giây.
D. 2895 giây.
Đáp án A
Ta có CM HNO3 = CM Cu(NO3)2
Vì thanh Fe còn dư ⇒ sản phẩm cuối cùng là Fe2+.
Ta có các pứ: 3Fe + 8HNO3 → 3Fe(NO3)2 + 2NO + 4H2O.
Sau đó: Fe + Cu(NO3)2 → Fe(NO3)2 + Cu↓.
Ta có: mGiảm = mFe – mCu = 56×( 3 a + a 8 + a) – 64a = 1,04.
<=> 13a = 1,04 <=> a = 0,08 mol.
⇒ nHNO3 = 0,08 ∑ne trao đổi = 0,08 mol ⇒ t = 0 , 08 × 96500 2 = 3860 giây.
Điện phân dd Cu(NO3)2 điện cực trơ, với cường độ dòng điện 3A, thu được dd X chứa hai chất tan có cùng nồng độ mol. Nhúng một thanh Fe vào dd X đến khi phản ứng xảy ra hoàn toàn, thu được khí NO là sản phẩm khử duy nhất, rút thành Fe ra cân lại thấy khối lượng thanh Fe giảm 1,56 gam so với ban đầu. Thời gian điện phân là
A. 3860 giây
B. 7720 giây
C. 5790 giây
D. 2895 giây
Đáp án A
Ta có: CM HNO3 = CM Cu(NO3)2
Vì thanh Fe còn dư
⇒ sản phẩm cuối cùng là Fe2+.
Ta có các pứ:
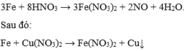
Ta có:
mGiảm = mFe – mCu
= 56×( + a) – 64a = 1,04.
Û 13a = 1,04
Û a = 0,08 mol.
⇒ nHNO3 = 0,08
∑ne trao đổi = 0,08 mol
⇒ t = 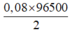 = 3860 giây
= 3860 giây
cho em hỏi
Có hai lá kẽm khối lượng như nhau. Một lá cho vào ddCu(NO3)2, lá kia cho vào dd Pb(NO3)2. Sau cùng một thời gian phản ứng khối lượng lá kẽm thứ nhất giảm 0.05 gam khối lượng lá kẽm thứ hai tăng hay giảm bao nhiêu gam ? Biết rằng trong cả 2 phản ứng khối lượng kẽm bị hòa tan như nhau
bạn viết 2 PTHH:
Cu + Zn(no3)2 ->Cu(no3)2 + Zn
X X
Cu + Pb(no3)2 ->Cu(no3)2 + Pb
X X
vì khối lượng kẽm bằng nhau nên số mol kẽm bằng nhau
gọi số mol 2 lá kẽm là X(mol)
ta có pt: mkhối lượng tăng= mzn- mCu =65X- 64X=0,05=>X=0,05
mlá kẽm thứ hai tăng=mPb -mCu =(207-64)✖0,05=7,1g
1.Cho m gam Mg vào dd chứa 0,3 mol fe(no3)3 và 0,71 mol cu(no3)2, sau một thời gian thu được (m+28) g kim loại. khối lượng Mg pư là : A.23,04 B.16,56 C.27,84 D.22,08
2.Cho 8,64 g Al vào dd X ( được tạo thành bằng cách hòa tan 74,7 g hỡn hợp Y gồm CuCl2 và FeCl3 vào nước). kết thúc pư thu được 17,76 g chất rắn gồm hai kim loại. tỉ lệ số mol fecl3 : cucl2 trong hỗn hợp Y là : A.2:1 B.3:2 C.3:1 D.5:3
3.Cho một thanh sắt có khối lượng m gam vào dd chứa 0,012 mol agno3 và 0,02 mol cu(no3)2, sau một thời gian khối lượng thanh săt là (m+14) g kim loại. Tính khối lượng của kim loại bám trên sắt : A.2,576 B.1,296 C.0,896 D.1,936
4.Nhúng thanh Fe vào 200mol dd fecl3 x (mol/l) và cucl2 y (mol/l). sau khi kết thúc phản ứng lấy thanh fe ra lau khô cẩn thận, cân lại thấy khôi lượng ko đổi so với trước pư. biết lượng Cu sinh ra bám hoàn toàn vào thanh Fe. tỉ lệ x:y
A.3:4 B. 1:7 C.2:7 D.4:5
5. Cho m g bột Fe vào dd X chứa agno3 và cu(no3)2 đến khi các pư kết thúc thu được cr Y và dd Z. cho dd Z tác dụng hết với dd NaOH dư, thu được a(g) kết tủa T gồm 2 hidroxit kim loại Nung T đến khối lượng ko đổi thu được b g cr. biểu thức liên hệ giữa m,a,b có thể là: A.m=8,225b-7a B.m=8,575b-7a C.m=8,4b-3a D. m=9b-6,5a
Bài 5:
\(\underrightarrow{BT:Fe}n_{Fe}=n_{Fe\left(OH\right)_2}=\dfrac{m}{56}\left(mol\right)\)
\(\rightarrow n_{Fe_2O_3}=\dfrac{m}{112}\left(mol\right)\rightarrow m_{Fe\left(OH\right)_2}=\dfrac{45}{28}m\left(gam\right)\)
mà \(m_{Fe_2O_3}+m_{CuO}=b\rightarrow m_{CuO}=\left(b-\dfrac{10}{7}m\right)gam\)
\(\underrightarrow{BT:Cu}m_{Cu\left(OH\right)_2}=\left(\dfrac{49b-70m}{40}\right)gam\)
Ta có: \(m_{Fe\left(OH\right)_2}+m_{Cu\left(OH\right)_2}=a\rightarrow\dfrac{45m}{28}+\dfrac{49b-70m}{40}\)
\(\rightarrow m=8,575b-7a\)
Vậy chọn đáp án B
Bài 2:
Bảo toàn khối lượng, ta có: \(133,5_{n_{AlCl_3}}+127_{n_{FeCl_2}}=m_{Al}+m_Y-m_{ran}=65,68\left(g\right)\)
Bảo toàn nguyên tố: \(n_{AlCl_3}=n_{Al}=0,32\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}n_{AlCl_3}=0,32\left(mol\right)\\n_{FeCl_2}=0,18\left(mol\right)\end{matrix}\right.\)
Trong Y có: \(\left\{{}\begin{matrix}133,5_{n_{CuCl_2}}=+162,5_{n_{FeCl_3}}=m_Y=74,7\\2n_{CuCl_2}+3n_{FeCl_3}=3n_{AlCl_3}+2n_{FeCl_2}=1,32\end{matrix}\right.\)
\(\Leftrightarrow\left\{{}\begin{matrix}n_{FeCl_3}=0,36\left(mol\right)\\n_{CuCl_2}=0,12\left(mol\right)\end{matrix}\right.\) Suy ra tỉ lệ là 3:1
Vậy chọn đáp án C
Bài 3:

Bài 4: