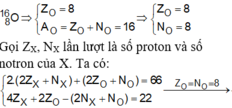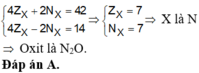Hợp chất B có có công thức X2O. Tổng số hạt là 92. Tìm CTHH của B.

Những câu hỏi liên quan
Tổng số hạt cơ bản của phân tử X2O là 92, trong đó số hạt mang điện hơn số hạt không mang điện là 28. X là(biết 8O) A. 11Na B. 19K C. 3Li D. 47Ag29. Hợp chất A có công thức: X3Y2 có tổng số hạt cơ bản là 150 trong đó tổng số hạt mang điện nhiều hơn số hạtkhông mang điện là 50. CT của A là A. Ca3N2 B. Mg3N2 C. Ca3P2 D. Mg3P230. Hợp chất B có công thức: X2Y có tổng số hạt cơ bản là 140 trong đó tổng số hạt mang điện nhiều hơn số hạtkhông mang điện là 44. Số hạt mang điện trong nguyên tử M nhiều hơ...
Đọc tiếp
Tổng số hạt cơ bản của phân tử X2O là 92, trong đó số hạt mang điện hơn số hạt không mang điện là 28. X là
(biết 8O) A. 11Na B. 19K C. 3Li D. 47Ag
29. Hợp chất A có công thức: X3Y2 có tổng số hạt cơ bản là 150 trong đó tổng số hạt mang điện nhiều hơn số hạt
không mang điện là 50. CT của A là A. Ca3N2 B. Mg3N2 C. Ca3P2 D. Mg3P2
30. Hợp chất B có công thức: X2Y có tổng số hạt cơ bản là 140 trong đó tổng số hạt mang điện nhiều hơn số hạt
không mang điện là 44. Số hạt mang điện trong nguyên tử M nhiều hơn trong nguyên tử Y là 22. CT của B là
A. Na2O B. Na2S C. K2O D. K2S
31. Hợp chất C có công thức: X3Y2 có tổng số hạt cơ bản là 222 trong đó tổng số hạt mang điện nhiều hơn số hạt
không mang điện là 74. Tổng số hạt mang điện trog X
2+ nhiều hơn tổng số hạt mang điện trong X3-
là 21. CT
của C là A. Ca3N2 B. Mg3N2 C. Ca3P2 D. Mg3P2
32. Một anion XO4
2-
có tổng số hạt là 146, trong đó tổng số hạt mang điện nhiều hơn tổng hạt không mang điện
là 50. Tên nguên tử X là A. P B. S C. 24Cr D. 25Mn
33. Tổng số hạt cơ bản của phân tử MClO3 là 182, trong đó tổng số hạt mang điện hơn tổng hạt không mang điện
là 68. M là A. Li B.Na C. K D. Rb
Mong giải và chi tiết cách giải. Tks
29. Hợp chất A có công thức: X3Y2 có tổng số hạt cơ bản là 150 trong đó tổng số hạt mang điện nhiều hơn số hạt không mang điện là 50. CT của A là A. Ca3N2 B. Mg3N2 C. Ca3P2 D. Mg3P2
---
\(\left\{{}\begin{matrix}6P_X+4P_Y-\left(3N_X+2N_Y\right)=50\\6P_X+4P_Y+3N_X+2N_Y=150\end{matrix}\right.\\ \Leftrightarrow\left\{{}\begin{matrix}6P_X+4P_Y=100\\3N_X+2N_Y=50\end{matrix}\right.\\ \Leftrightarrow\left\{{}\begin{matrix}3P_X+2P_Y=50\\3N_X+2N_Y=50\end{matrix}\right.\\ \Leftrightarrow P_X+P_Y=N_X+N_Y\\ \)
Xét thấy chỉ có trường hợp: PX=12 =NX; PY=7=NY là thỏa mãn
=> Chọn B
Đúng 0
Bình luận (0)
30. Hợp chất B có công thức: X2Y có tổng số hạt cơ bản là 140 trong đó tổng số hạt mang điện nhiều hơn số hạt
không mang điện là 44. Số hạt mang điện trong nguyên tử M nhiều hơn trong nguyên tử Y là 22. CT của B là
A. Na2O B. Na2S C. K2O D. K2S
---
\(\left\{{}\begin{matrix}4P_X+2P_Y+2N_X+N_Y=140\\4P_X+2P_Y-\left(2N_X+N_Y\right)=44\\2P_X-2P_Y=22\end{matrix}\right.\\ \Leftrightarrow\left\{{}\begin{matrix}4P_X+2P_Y+2N_X+N_Y=140\\4P_X+2P_Y-\left(2N_X+N_Y\right)=44\\P_X=11+P_Y\end{matrix}\right.\\ \Leftrightarrow\left\{{}\begin{matrix}4P_X+2P_Y=92\\2N_X+N_Y=52\\P_X=11+P_Y\end{matrix}\right.\\ \Leftrightarrow\left\{{}\begin{matrix}44+6P_Y=92\\2N_X+N_Y=52\\P_X=P_Y+11\end{matrix}\right.\\ \Leftrightarrow\left\{{}\begin{matrix}P_Y=Z_Y=8\\P_X=Z_X=19\end{matrix}\right.\)
=> X là Kali còn Y là Oxi
-> CTHH K2O
Đúng 0
Bình luận (0)
Bài 1: Oxit B có công thức là X2O. Tổng số hạt cơ bản trong B là 92, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 28. Tính số hạt mỗi loại trong X biết O có p = n = e = 8.
Gọi số hạt mang điện là 2Z, số hạt không mang điện là N
Ta có: \(\left\{{}\begin{matrix}2Z_{\left(phân.tử\right)}+N_{\left(phân.tử\right)}=92\\2Z_{\left(phân.tử\right)}-N_{\left(phân.tử\right)}=28\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}Z_{\left(phân.tử\right)}=30\\N_{\left(phân.tử\right)}=32\end{matrix}\right.\)
Mà \(p_{Oxi}=n_{Oxi}=e_{Oxi}=8\) \(\Rightarrow\left\{{}\begin{matrix}p_X=e_X=\dfrac{30-8}{2}=11\\n_X=\dfrac{32-8}{2}=12\end{matrix}\right.\)
X là Natri
Đúng 4
Bình luận (0)
Cho biết CTHH hợp chất của nguyên tố X với oxi và hợp chất của nguyên tố Y với H là X2O và YH2.Hãy chọn công thức đúng cho hợp chất của X và Y trong số các công thức sau: XY2, X2Y, XY, X2Y3.
Xác định X, Y biết rằng:
- Hợp chất X2O có PTK là 62
- Hợp chất YH2 có PTK là 34.
Xác định X, Y biết rằng:
- Hợp chất X2O có PTK là 62
=> X hóa trị I
- Hợp chất YH2 có PTK là 34.
=> Y hóa trị II
=> Công thức đúng cho hợp chất của X và Y là X2Y
Đúng 3
Bình luận (0)
Hợp chất X2O có tổng số hạt cơ bản là 92, số hạt mang điện nhiều hơn số hạt không mang điện là 28. X là nguyên tố nào dưới đây?
A. Na
B. Ag
C. K
D. Cu
2 nguyên tử A và B tạo thành hợp chất có công thức A2B (phân tử). Trong phân tử A2B có tổng các hạt là 92, trong đó số hạt mang điện nhiều hơn không mang điện là 28. Trong hạt nhân nguyên tử số hạt mang điện của A nhiều hơn của B là 3. Tìm P của A và P của B Làm theo cách lớp 7 giúp mik với nha, mik đg cần gấp
Đọc tiếp
2 nguyên tử A và B tạo thành hợp chất có công thức A2B (phân tử). Trong phân tử A2B có tổng các hạt là 92, trong đó số hạt mang điện nhiều hơn không mang điện là 28. Trong hạt nhân nguyên tử số hạt mang điện của A nhiều hơn của B là 3. Tìm P của A và P của B Làm theo cách lớp 7 giúp mik với nha, mik đg cần gấp
hợp chất A có công thức hóa học RX2 trong đó R chiếm 63,22% về khối lượng trong hạt nhân của nguyên tử R có số hạt không mang điện nhiều hơn số hạt mang điện là 5 hạt trong hạt nhân nguyên tử X có số hạt mang điện bằng số hạt không mang điện tổng số hạt P trong phân tử RX2 là 41 hạt tìm CTHH của hợp chất A2 một hợp chất hữu cơ có thành phần khối lượng các nguyên tố như sau 85,7% C;14,3% H biết phân tử hợp chất nặng gấp 28 lần phân tử hidro tìm CTHH của hợp chất đóLÀM NHANH VÀ DỄ HIỂU NHÉ CHIỀU M...
Đọc tiếp
hợp chất A có công thức hóa học RX2 trong đó R chiếm 63,22% về khối lượng trong hạt nhân của nguyên tử R có số hạt không mang điện nhiều hơn số hạt mang điện là 5 hạt trong hạt nhân nguyên tử X có số hạt mang điện bằng số hạt không mang điện tổng số hạt P trong phân tử RX2 là 41 hạt tìm CTHH của hợp chất A
2 một hợp chất hữu cơ có thành phần khối lượng các nguyên tố như sau 85,7% C;14,3% H biết phân tử hợp chất nặng gấp 28 lần phân tử hidro tìm CTHH của hợp chất đó
LÀM NHANH VÀ DỄ HIỂU NHÉ CHIỀU MAI MÌNH CẦN RỒI MÌNH THANK TRƯỚC NHA
mik làm câu 2 nhé
M phân tử =2.28=56 g
khối lượng của C trong 1 mol hợp chất:mC=56.85,7%=48 g
n C=48:12=4 mol
khối lượng của H trong 1 mol hợp chất : mH=56-48=8 g
n H=8:1=8 mol
trong 1 mol hợp chất có 4 mol C 8 mol H
vậy cthh: C4H8
Đúng 0
Bình luận (0)
Một oxit có công thức X2O có tổng số hạt trong phân tử là 66 và số hạt mang điện nhiều hơn số hạt không mang điện là 22 hạt. Công thức của oxit là (biết số khối của oxi bằng 16): A.N2O. B. Na2O. C. K2O. D. Cu2O.
Đọc tiếp
Một oxit có công thức X2O có tổng số hạt trong phân tử là 66 và số hạt mang điện nhiều hơn số hạt không mang điện là 22 hạt. Công thức của oxit là (biết số khối của oxi bằng 16):
A.N2O.
B. Na2O.
C. K2O.
D. Cu2O.
Hợp chất X có công thức AB2 ( A,B là 2 ngtố hóa học ). Tổng số hạt mang điện có tr.ong một phân tử X là 70. 1 số hạt mang điện trong nguyên tử A nhiều hơn trong nguyên tử B là 22. a)Tìm công thức hóa học của X .b) Tính tổng số các loại hạt có trong một phân tử X Giải chi tiết, kĩ
a: Theo đề, ta có: \(\left\{{}\begin{matrix}2Z_A+4Z_B=70\\2Z_A-2Z_B=22\end{matrix}\right.\)
=>ZA+2ZB=35 và ZA-ZB=11
=>ZA=19 và ZB=8
=>A là KO2
Đúng 0
Bình luận (1)
Một hợp chất có công thức phân tử là M2X.Tổng số hạt trong phân tử M2X là 92 hạt,trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 28.Tổng số hạt trong M+ lớn hơn trong X2- là 7.Số khối của M+ lớn hơn của X2- là 7.Tìm M,X,M2X (biết C(Z=6),N(Z=7),O(Z=8),F(Z=9),Na(Z=11),Mg(Z=12),Al(Z=13),S(Z=16),Cl(Z=17),K(Z=19),Ca(Z=20),Fe(Z=26),Cu(Z=29))
Ta có: P = E (do nguyên tử trung hòa về điện)
- Tổng số hạt trong M2X là 92.
⇒ 2.2PM + 2NM + 2PX + NX = 92 (1)
- Trong đó, số hạt mang điện nhiều hơn số hạt không mang điện là 28.
⇒ 2.2PM + 2PX - 2NM - NX = 28 (2)
- Tổng số hạt trong M+ lớn hơn X2- là 7.
⇒ (2PM + NM - 1) - (2PX + NX + 2) = 7 (3)
- Số khối của M+ lớn hơn X2- là 7.
⇒ PM + NM - (PX + NX) = 7 (4)
Từ (1), (2), (3) và (4) \(\Rightarrow\left\{{}\begin{matrix}P_M=E_M=11=Z_M\\N_M=12\\P_X=E_X=8=Z_X\\N_X=8\end{matrix}\right.\)
→ M là Na, X là O, M2X là Na2O.
Đúng 1
Bình luận (0)