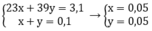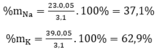Cho 3,33g một kim loại kiềm M tác dụng hoàn toàn với 100ml nước (d=1g/ml) thì thu được 0,48g khí H2 (đktc)
a) tìm tên kl đó
b) Tính nồng độ Phần trăm của dd thu đc
M.n ơi..........giúp mk với ạ.....mk đang cần gấp.......mk cảm ơn ạ
cho 3,33 gam một kim loại kiềm R có tác dụng hoàn toàn với 200 gam nước thì thu được 5,376 lít khí H2 (đktc)
A) tìm tên kim loại đó
b) tính nồng độ phần trăm của dung dịch thu được sau phản ứng
Cho 3,33g 1 kim loại kiềm M tác dụng hoàn toàn với 100ml nước (d=1g/ml)thì thu được 0,48g khí \(H_2\)(đktc)
a)Tìm tên kim loại đó
b)Tính nồng độ % của dung dịch thu được
\(m_{H_2O}=V.d=100.1=100gam\)
\(n_{H_2}=\dfrac{m}{M}=\dfrac{0,48}{2}=0,24mol\)
2M+2H2O\(\rightarrow\)2MOH+H2
\(n_M=2n_{H_2}=2.0,24=0,48mol\)
M=\(\dfrac{3,33}{0,48}=6,9375\approx7\)(Li)
\(n_{LiOH}=n_{Li}=0,48mol\rightarrow m_{LiOH}=0,48.24=11,52gam\)
\(m_{dd}=3,33+100-0,48=102,85gam\)
C%LiOH=\(\dfrac{11,52}{102,85}.100\approx11,2\%\)
cho 3.33g 1 kim loại kiềm M tác dụng hoàn toàn với 100ml nước (d=1g/ml) thì thu được 0,48g khí H2
a, tìm tên kim loại đó
b, tính nồng độ phần trăm của dung dịch thu được
a) 2M+ 2nH2O--->2M(OH)n +nH2
Ta có
n\(_{H2}=\frac{0,48}{2}=0,24\left(mol\right)\)
Theo pthh
n\(_M=\frac{2}{n}n_{H2}=\frac{0,48}{n}mol\)
=> M\(_M=3,33:\frac{0,48}{n}=\frac{3,33n}{0,48}=7\)
Ta có
| n | M |
| 1 | 7(Li) |
| 2 | 14 |
| 3 | 21 |
Bậy M là Li
b)m\(_{H2O}=100.1=100\left(g\right)\)
Theo pthh
n\(_{LiOH}=n_{H2}=0,24\left(mol\right)\)
m\(_{LiOH}=0,24.24=5,76\left(g\right)\)
C%=\(\frac{5,76}{100+3,33.0,48}.100\%=5,6\%\)
Chúc bạn học tốt
Cho 7,8g 1 kim loại kiềm ( kim loại nhóm 1A ) tác dụng hoàn toàn với 200ml nc thì thu đc 2,479 lít khí H2 ( đktc). Tính nồng độ mol của dung dịch kiềm thu đc
Ta có: \(n_{H_2}=\dfrac{2,479}{24,79}=0,1\left(mol\right)\)
Gọi KL kiềm là A.
PT: \(2A+2H_2O\rightarrow2AOH+H_2\)
Theo PT: \(n_{AOH}=2n_{H_2}=0,2\left(mol\right)\)
\(\Rightarrow C_{M_{AOH}}=\dfrac{0,2}{0,2}=1\left(M\right)\)
Cho 3,9g một kim loại kiềm tác dụng với H2O dư thu được 1,12 lít H2 đktc tìm tên kim loại đó. Cho kim loại trên tác dụng với 500g nước thì thu được dung dịch có nồng độ %là bao nhiêu?
\(n_{H_2}=\dfrac{v}{22,4}=\dfrac{11,2}{22,4}=0,05mol\)
-Gọi A là kim loại kiềm
2A+2H2O\(\rightarrow\)2AOH+H2
\(n_A=2n_{H_2}=2.0,05=0,1mol\)
\(M_A=\dfrac{m_A}{n_A}=\dfrac{3,9}{0,1}=39\left(K\right)\)
\(n_{KOH}=n_K=0,1mol\rightarrow m_{KOH}=0,1.56=5,6gam\)
\(m_{dd}=m_K+m_{H_2O}-m_{H_2}=3,9+500-0,05.2=503,8gam\)
C%KOH=\(\dfrac{5,6.100}{503,8}\approx\)1,11%
-Gọi X là kim loại kiềm cần tìm
Ta có: \(n_{H_2}=\dfrac{1,12}{22,4}=0,05mol\)
PTHH: \(2X+2H_2O\rightarrow2XOH+H_2\)
=> 0,1mol 0,1mol 0,05mol
\(M_X=\dfrac{m}{n}=\dfrac{3,9}{0,1}=39\)
Vậy kim loại X cần tìm là Kali (K)
Ta có: \(m_{KOH}=0,1.\left(39+16+1\right)=5,9\left(g\right)\)
\(m_{ddKOH}=m_K+m_{H_2O}-m_{H_2}=3,9+500-\left(0,05.2\right)=503,8\left(g\right)\)
\(C\%=\dfrac{m_{KOH}}{m_{ddKOH}}.100\%=\dfrac{5,9}{503,8}.100\%\approx1,17\%\)
Nhờ mn giải giúp mik mấy bài hóa HSG này vs, mik đag rất cần,mik tks nhiều:
Câu 1: Khử hoàn toàn 8,12g một ôxit kim loại bằng khí CO ở nhiệt độ cao. Dẫn toàn bộ khí sinh ra vào bình đựng dd Ca(OH)2 dư thấy tạo thành 14g kết tủa. Nếu lấy lượng kim loại sinh ra hòa tan hết vào dd HCl dư thì thu đc 2,352l khí ở đktc. Xác định công thức của ôxit kim loại.
Câu 2: Cho 13,12g tinh thể Al2(SO4)3. 18H2O hòa tan vào nước đc dd A. Cko 250ml dd KOH PƯ hết với dd A thu đc 1,17g kết tủa. Tính nồng độ mol của dd KOH có thể sử dụng để tạo kết tủa trên.
Câu 3: Trộn 100g dd chứa muối Sunfát của một kin loại kiềm, nồng độ 16,4% với 100g dd KHCO3 4,4%. Sau khi PƯ kết thức thu đc dd A có khối lượng < 200g. Cho 200g dd BaCl2 6,24% vào dd C thu đc dd D. dd D còn có thể PƯ đc vs dd H2SO4. Hãy Xác định công thức muối sunfát kim loại kiềm ban đầu.
Câu 4: Đun nóng 16,8l khí hiđro (đktc) với Cacbon ở 500 độ C và có Ni làm xúc tác, thu đc hh khí gồm CH4 và H2. Tỷ khối hơi của hh khí so vs hiđo bằng 4,5. Đốt cháy hoàn toàn hh khí đó rồi cho sản phẩm hấp thụ vào 200ml dd NaOH 8% (d=1,1g/ml).
1- Tính hiệu suất PƯ giữa hiđro và Cacbon
2- Tính nồng độ mol/lít của dd thu đc sau PƯ đốt cháy hh
Cho 5,76 g kim loại kiềm thổ tác dụng với 360ml dung dịch HCl C% (d=1,1g/ml) thu được 5,376 lít khí
(đktc) và dung dịch A.
a. Tìm tên kim loại?
b. Xác định nồng độ phần trăm của các chất tan trong dung dịch A và giá trị C%.
Cho natri tác dụng với 100ml rượu 11,5 độ. (A) Tính thể tích khí hiđro thu đc (đktc) biết D r = 0,8g/ml, D nước = 1g/ml (B) Tính khối lượng natri etylic thu đc (giúp tui zới camon ạ)
Cho 3,1 g hỗn hợp gồm hai kim loại kiềm ở hai chu kì kế tiếp nhau trong bảng tuần hoàn tác dụng hết với nước thu được 1,12 lít H2 ở đktc và dung dịch kiềm. Xác định tên 2 KL đó và tính thành phần phần trăm khối lượng mỗi kim loại
Gọi công thức chung cho hai kim loại kiềm là M
Số mol H2: nH2 = 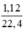 = 0,05(mol)
= 0,05(mol)
PTHH: 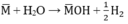
Theo pt: nM = 2. nH2 = 2. 0,05 = 0,1(mol)
⇒ M = 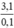 = 31 → Na, K
= 31 → Na, K
Gọi x, y lần lượt là số mol của Na và K trong hỗn hợp
Theo bài ra ta có hệ phương trình: